
| A. | 钢铁制品表面水膜的酸性较强时,正极的电极反应:2H++2e-═H2↑ | |
| B. | 常温下,氯化铵溶液呈酸性:NH4++OH-?NH3•H2O | |
| C. | 向硫酸镁溶液中加入Ba(OH)2溶液,将溶液中的SO42-完全沉淀下来:SO42-+Ba2+═BaSO4↓ | |
| D. | 向氯化银浊液中加入硫化钠溶液产生黑色沉淀:2Ag++S2-═Ag2S↓ |
分析 A.酸性较强时,钢铁发生析氢腐蚀;
B.氯化铵水解生成一水合氨和氢离子;
C.生成氢氧化镁和硫酸钡沉淀;
D.AgCl不溶于水,应写成化学式.
解答 解:A.酸性较强时,钢铁发生析氢腐蚀,正极上析出氢气,电极方程式为2H++2e-═H2↑,故A正确;
B.氯化铵水解生成一水合氨和氢离子,水解的离子方程式为NH4++H2O?NH3•H2O+H+,故B错误;
C.生成氢氧化镁和硫酸钡沉淀,离子方程式为SO42-+Ba2++2OH-+Mg2+=BaSO4↓+Mg(OH)2↓,故C错误;
D.AgCl不溶于水,应写成化学式,离子方程式为2AgCl+S2-═Ag2S+2Cl-,故D错误.
故选A.
点评 本题考查离子反应书写的正误判断,为高考中的经典题型,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
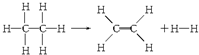
| A. | 该反应放出251.2 kJ的热量 | B. | 该反应吸收251.2 kJ的热量 | ||
| C. | 该反应放出125.6 kJ的热量 | D. | 该反应吸收125.6 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Y>Z | B. | Y>X>Z | C. | X>Z>Y | D. | Y>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 反应时间/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50s的平均速率v(PCl5)=0.0032mol•L-1•s-1 | |
| B. | 保持其他条件不变,若升高温度,反应重新达到平衡,平衡时c(PCl3)=0.11mol•L-1,则正反应的△H<0 | |
| C. | 相同温度下,若起始时向容器中充入1.0molPCl5和0.20 molCl2,在反应达到平衡前v(正)>v(逆) | |
| D. | 相同温度下,若起始时向容器中充入1.0molPCl5和1.0 molCl2,在反应达到平衡时PCl5的转化率为80% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
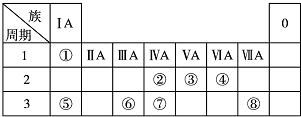
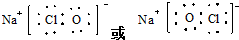 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 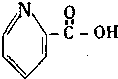 维生素 | B. | 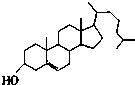 胆固醇 | ||
| C. | 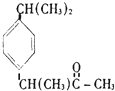 芬必得 | D. | 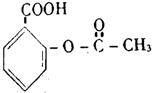 阿斯匹林 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2通入Na2S溶液中,能产生淡黄色沉淀 | |
| B. | HCl的热稳定性比H2S强 | |
| C. | HClO4的酸性比H2SO4强 | |
| D. | HCl的酸性比H2S强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com