
【题目】298K时,用0.1000mol/L NaOH溶液滴定20.00mL同浓度的甲酸溶液过程中溶液pH与NaOH溶液体积的关系如图所示(已知:HCOOH溶液的Ka=l.0×10-4.0)

下列有关叙述正确的是
A. 该滴定过程应该选择甲基橙作为指示剂
B. 图中a、b两点氷的电离程度:b>a
C. 当加入10.00mL NaOH溶液时,溶液中:c(HCOO)>c(H+)>c(Na+)>c(OH)
D. 当加入20.00mL NaOH溶液时,溶液pH>8.0
【答案】D
【解析】
A.用NaOH溶液滴定甲酸溶液,恰好发生反应产生HCOONa溶液,该盐是强碱弱酸盐,选择在碱性范围内变色的指示剂酚酞试液误差较小,A错误;
B.图中a为HCOONa、HCOOH按1:3关系混合得到的混合溶液;b为HCOONa、NaOH按1:3关系混合得到的混合溶液,由于甲酸是弱酸,对水的电离的抑制程度小于等浓度的NaOH溶液,所以a、b两点氷的电离程度:a>b,B错误;
C.当加入10.00mL NaOH 溶液时,溶液为等浓度的HCOONa、HCOOH的混合溶液,根据图示可知此时溶液的pH<7,说明HCOOH的电离作用大于HCOO-的水解作用,所以c(H+)>c(OH-),c(HCOO-)>c(Na+),盐电离产生的离子浓度大于弱电解质电离产生的离子浓度,因此c(Na+)>c(H+),所以离子浓度大小关系为:c(HCOO-)>c(Na+)>c(H+)>c(OH-),C错误;
D.当加入20.00mL NaOH溶液时,二者恰好反应产生HCOONa,该盐是强酸弱碱盐,HCOO-水解,使溶液显碱性,HCOO-+H2O![]() HCOOH+OH-,c(HCOO-)=
HCOOH+OH-,c(HCOO-)=![]() =0.0500mol/L,Kh=
=0.0500mol/L,Kh=![]() =10-10,Kh=
=10-10,Kh=![]() ,所以c(OH-)=
,所以c(OH-)=![]() ,所以溶液的pH>8,D正确;
,所以溶液的pH>8,D正确;
故合理选项是D。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子半径依次增大,X是短周期元素中原子半径最小的,Z、W同主族,且Z、W的原子序数之差与Y的原子序数相同,X、Y、Z、W的最外层电子数之和为15。下列说法正确的是( )
A. Z单质与WYZ在高温条件下反应生成W单质,说明非金属性:Z>W
B. 向无色的X2Z2Y4溶液中滴加少量酸性高锰酸钾溶液,溶液仍为无色,体现了X2Z2Y4的还原性
C. Y、Z、W的简单氢化物的稳定性依次增强
D. 由X、Y两种元素形成的所冇化合物中所含化学键的类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨浸菱锌矿制备活性氧化锌,成本低,选择性好,其工艺流程如下:

(1)滤渣Ⅰ主要成分的化学式为___________。
(2)浸取液中含少量Pb2+、Cu2+等重金属离子,可加入试剂Ⅰ除去,试剂Ⅰ为___________,在实际操作过程中加入量远高于理论量,可能的原因是___________。
(3)过滤Ⅱ后得到Zn(NH3)4CO3溶液,经水蒸汽加热法可析出碱式 [ZnCO3·2Zn(OH)2·H2O]沉淀,其反应化学方程式为___________。
(4)蒸氨过程中会有部分氨气逸出,可用电化学气敏传感器监测环境中NH3的含量,原理如图所示。负极的电极反应为___________,假设蒸氨过程中逸出氨气16.8L (标准状况)进入传感器,另一极需要通入标准状况下O2的体积为___________。

(5)蒸氨完成时,废液中残余氨含量需小于0.2mol/L,若残余氨浓度过低,水蒸汽用量增大,回收氨水中氨浓度降低,不利于循环使用;若残余氨浓度过高,会导致___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,分别向A、B两室充入H2、O2的混合气体和1 mol空气,此时活塞的位置如图所示。
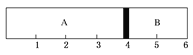
(1)A室混合气体的物质的量为________,标况下体积为________。
(2)实验测得A室混合气体的质量为34 g,则该混合气体的密度是同温同压条件下氦气密度的________倍。若将A室H2、O2的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在________刻度,容器内气体压强与反应前气体压强之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法错误的是
A. 12.5mL 16mol/L浓硫酸与足量锌充分反应,转移电子数为0.2NA
B. 5.8g熟石膏(2CaSO4 H2O)含有的结晶水分子数为0.02NA
C. 92.0g甘油(丙三醇)和甲苯的混合物中含氢原子数为8.0NA
D. 标准状况下,1L甲醛气体完全燃烧消耗O2分子个数约为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰酸锂离子蓄电池是第二代锂离子动力电池。一种以软锰矿浆(主要成分为MnO2,含少量 Fe2O3、FeO、A12O3、SiO2等杂质)为原料制备锰酸锂的流程如下图所示。

(1)溶浸生产中为提高SO2回收率可采取的措施有_________(填序号)
a.不断搅拌,使SO2和软锰矿浆充分接触
b.增大通入SO2的流速
c.减少软锰矿浆的进入量
d.减小通入SO2的流速
(2)已知:室温下,Ksp[A1(OH)3]=1×10-33,Ksp[Fe(OH)3]=l×10-39, pH=7.1 时 Mn(OH)2开始沉淀。氧化除杂时(室温)除去MnSO4液中的Fe3+、Al3+(使其浓度小于1× l0-6mol /L),需调节溶液pH范围为_______。
(3)由硫酸锰与K2S2O8溶液常温下混合一周,慢慢得到球形二氧化锰(MnO2)。请写出发生反应的离子方程式___________。
(4)将MnO2和 Li2CO3按4:1的物质的量比配料,混合搅拌,然后升温至600℃750℃,制取产品LiMn2O4。写出该反应的化学方程式 _____________ 。
(5)锰酸锂可充电电池的总反应为:Li1-xMn2O4+LixC![]() LiMn2O4+C(0<x<1)
LiMn2O4+C(0<x<1)

①充电时,电池的阳极反应式为_________,若此时转移lmole-,则石墨电极将增重______g。
②废旧锰酸锂电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异黄酮类化合物在杀虫方面特别对钉螺有较好的杀灭作用,我国科学家研究了一种异黄酮类化合物的合成路线如下:

回答下列问题:
(1)A的化学名称为 ______。
(2) B中含氧官能团的名称是_____。
(3) B到C的反应类型是_____。
(4)写出C与足量氢氧化钠溶液反应的化学方程式_____。
(5) D的结构简式为_____。
(6)写出与B互为同分异构体的能使Fe3+显色且能发生水解反应的化合物的结构简式(核磁共振氢谱为四组峰,峰面积比为1 : 2 : 2 : 3) _____。
(7)请设计由苯酚和溴丙烷为起始原料制备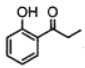 的合成路线(无机试剂任选) _____。
的合成路线(无机试剂任选) _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬[(CH3COO)2CrH2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬(溶液呈绿色)还原为二价铬(溶液呈亮蓝色);二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如下,请回答以下问题:

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是___________________,仪器a的名称是___________。
(2)将过量的锌和氧化铬固体置于c中,加入少量蒸馏水,按图连接好,打开K1、K2,关闭K3。此时观察到c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为_____________________;过量锌的作用是______________________________________________。
(3)打开K3,关闭K1、K2,观察到现象为___________________________、d中出现砖红色沉淀,为得到纯净的砖红色晶体,需采取的操作是__________、__________、洗涤、干燥。
(4)装置d可能存在的缺点为_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,回答下列问题:
(1)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g) = SiH2Cl2(g) +SiCl4(g) △H1 = +48kJ/mol
4SiHCl3(g) = SiH4(g) + 3SiCl4(g) △H3 = +114kJ/mol
则反应3SiH2Cl2(g) = SiH4(g) + 2SiHCl3(g)的△H=______________kJ/mol。
(2)对于反应2SiHCl3(g) = SiH2Cl2(g) +SiCl4(g),采用合适的催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。

①323 K时反应的平衡转化率ɑ =______%。比较a、b处反应速率大小:υa_____υb(填“>”、“<”、“=”)
②在343 K下:要提高SiHCl3平衡转化率,可采取的措施是_______,要缩短反应达到平衡的时间,可采取的措施有_______。(两问均从下列选项中选择合适的选项填空)
A、增大反应物浓度
B、增大压强
C、及时将产物从体系分离
D、使用更高效的催化剂
③某温度(T K)下,该反应可使SiHCl3的平衡转化率达到30%,则该温度下的平衡常数KT K___K343 K(填“>”、“<”、“=”),已知反应速率υ=υ正-υ逆=k正x2(SiHCl3)-k逆x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算在该温度下当转化率为20%的时刻,υ正/υ逆=_____________(保留1位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com