
 H++C2O42-
H++C2O42- H++C2O42-
H++C2O42-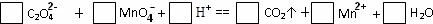
 H++C2O42-,电离程度大于水解程度,
H++C2O42-,电离程度大于水解程度, H++C2O42-;
H++C2O42-;| 0.0016×5 |
| 2 |
| 3×10-3mol×128g/mol |
| 6.0 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
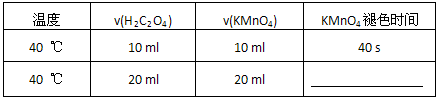
| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40℃ | 10ml | 10ml | 40s |
| 40℃ | 20ml | 20ml |
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。草酸的盐可用作碱土金属离子的广谱沉淀剂。
(1)40 ℃时混合一定体积的0.1 mol/L H2C2O4溶液与一定体积0.01 mol/L酸性KMnO4溶液,填写表中空格。
| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40 ℃ | 10 ml | 10 ml | 40 s |
| 40 ℃ | 20 ml | 20 ml |
|
(2)用甲基橙作指示剂,通过酸碱滴定可测定草酸溶液浓度。甲基橙是一种常用的酸碱指示剂,甲基橙(用化学式HIn表示)本身就是一种有机弱酸,其电离方程式为:HInH++In—。则酸根离子In—的颜色是 。甲基橙的酸性与草酸相比, (填前者强、前者弱、十分接近、无法判断)。
(3)常温下有pH均为3的盐酸和草酸溶液各10 ml,加水稀释,在答题卷上画出稀释过程中两种溶液中c(H+)变化的示意图并作必要的标注。
(4)常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5 mol/L时可认为该离子已沉淀完全。现为了沉淀1 L0.01 mol/LMgCl2溶液中的Mg2+,加入100 mL0.1 mol/L的(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全。
(5)(NH4)2C2O4溶液因NH4+水解程度稍大于C2O42-而略显酸性,0.1 mol/L(NH4)2C2O4溶液pH值6.4。现有某未知溶液,常温下由水电离出的c(H+)=1.0×10-5 mol/L,该溶液pH可能是 (填字母)。
A.5 B.6 C.7 D.9
查看答案和解析>>
科目:高中化学 来源:2011-2012届广东省韶关市高三下学期第二次调研考试化学试卷(带解析) 题型:填空题
(16分)草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。草酸的盐可用作碱土金属离子的广谱沉淀剂。
(1)40 ℃时混合一定体积的0.1mol/L H2C2O4溶液与一定体积0.01mol/L酸性KMnO4溶液,填写表中空格。
| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40 ℃ | 10 ml | 10 ml | 40 s |
| 40 ℃ | 20 ml | 20 ml | |
 H++In—。则酸根离子In—的颜色是 。甲基橙的酸性与草酸相比, (填前者强、前者弱、十分接近、无法判断)。
H++In—。则酸根离子In—的颜色是 。甲基橙的酸性与草酸相比, (填前者强、前者弱、十分接近、无法判断)。
查看答案和解析>>
科目:高中化学 来源:2011-2011-2012学年广东省韶关市高三下学期第二次调研考试化学试卷(解析版) 题型:填空题
(16分)草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。草酸的盐可用作碱土金属离子的广谱沉淀剂。
(1)40 ℃时混合一定体积的0.1 mol/L H2C2O4溶液与一定体积0.01 mol/L酸性KMnO4溶液,填写表中空格。
|
温度 |
v(H2C2O4) |
v(KMnO4) |
KMnO4褪色时间 |
|
40 ℃ |
10 ml |
10 ml |
40 s |
|
40 ℃ |
20 ml |
20 ml |
|
(2)用甲基橙作指示剂,通过酸碱滴定可测定草酸溶液浓度。甲基橙是一种常用的酸碱指示剂,甲基橙(用化学式HIn表示)本身就是一种有机弱酸,其电离方程式为:HIn H++In—。则酸根离子In—的颜色是
。甲基橙的酸性与草酸相比,
(填前者强、前者弱、十分接近、无法判断)。
H++In—。则酸根离子In—的颜色是
。甲基橙的酸性与草酸相比,
(填前者强、前者弱、十分接近、无法判断)。
(3)常温下有pH均为3的盐酸和草酸溶液各10 ml,加水稀释,在答题卷上画出稀释过程中[来源:Z*xx*k.Com]两种溶液中c(H+)变化的示意图并作必要的标注。
(4)常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5 mol/L时可认为该离子已沉淀完全。现为了沉淀1 L0.01 mol/LMgCl2溶液中的Mg2+,加入100 mL0.1 mol/L的(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全。
(5)(NH4)2C2O4溶液因NH4+水解程度稍大于C2O42-而略显酸性,0.1 mol/L(NH4)2C2O4溶液pH值6.4。现有某未知溶液,常温下由水电离出的c(H+)=1.0×10-5 mol/L,该溶液pH可能是 (填字母)。
A.5 B.6 C.7 D.9
查看答案和解析>>
科目:高中化学 来源:广东省模拟题 题型:填空题
 H++In-。则酸根离子In-的颜色是_____________。甲基橙的酸性与草酸相比,__________(填前者强、前者弱、十分接近、无法判断)。
H++In-。则酸根离子In-的颜色是_____________。甲基橙的酸性与草酸相比,__________(填前者强、前者弱、十分接近、无法判断)。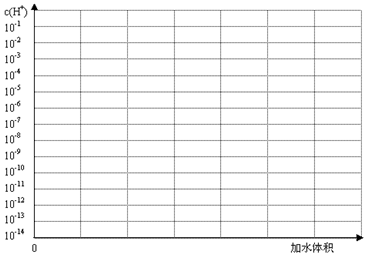
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com