
×Ō“Ó1985Äź·¢ĻÖĮĖø»ĄÕĻ©ŅŌĄ“£¬ÓÉÓŚĘä¾ßÓŠ¶ĄĢŲµÄĪļĄķŗĶ»ÆѧŠŌÖŹ,Ō½Ą“Ō½ŹÜµ½ČĖ
ĆĒµÄ¹Ų×¢”£
£Ø1£©ø»ĄÕĻ©£ØC60£©ŌŚŅŗĻąÖŠÓĆFeCl3“ß»ÆæÉÉś³É¶ž¾ŪĢ壬¹ż³Ģ¼ūĶ¼21A”Ŗ1”£
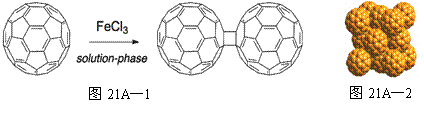 |
¢ŁFe3+»łĢ¬Ź±ŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ £»
¢Ś1molC60·Ö×ÓÖŠŗ¬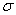 ¼üŹżÄæĪŖ £»
¼üŹżÄæĪŖ £»
¢Ūø»ĄÕĻ©¶ž¾ŪĢåÖŠĢ¼Ō×ÓŌӻƹģµĄĄąŠĶÓŠ ”£
£Ø2£©C60µÄ¾§°ū½į¹¹ČēĶ¼21A”Ŗ2£¬ŌņÓėĆæøöC60·Ö×Ó½ōĮŚµÄC60·Ö×ÓÓŠ øö”£
£Ø3£©ĪŅ¹śæĘѧ¼Ņ·¢ĻÖ±[8]·¼Ģž£ØČēĶ¼21A”Ŗ3ĖłŹ¾£©ÄÜÓėC60ŠĪ³É°üŗĻĪļ£ØČēĶ¼21A”Ŗ4£©£¬
¢Ł±[8]·¼Ģžµ×²æ8øöōĒ»ł¼äµÄ×÷ÓĆĪŖ £»
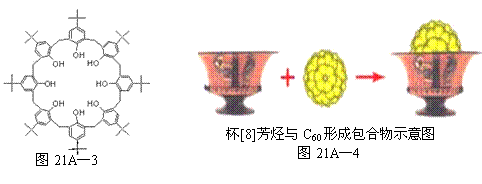 ¢Ś±[8]·¼Ģž°üŗĻĪļÖŠC60Óė±·¼Ģž¼äµÄ×÷ÓĆĮ¦ĪŖ ”£
¢Ś±[8]·¼Ģž°üŗĻĪļÖŠC60Óė±·¼Ģž¼äµÄ×÷ÓĆĮ¦ĪŖ ”£

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
H2ÓėO2·¢Éś·“Ó¦µÄ¹ż³ĢÓĆÄ£ŠĶĶ¼Ź¾ČēĻĀ£Ø”°©”±±ķŹ¾»Æѧ¼ü£©£ŗĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©
| ”” | A£® | ¹ż³Ģ¢ńŹĒĪüČČ¹ż³Ģ |
| ”” | B£® | ¹ż³Ģ¢óŅ»¶ØŹĒ·ÅČČ¹ż³Ģ |
| ”” | C£® | øĆ·“Ó¦¹ż³ĢĖłÓŠ¾É»Æѧ¼ü¶¼¶ĻĮŃ£¬ĒŅŠĪ³ÉĮĖŠĀ»Æѧ¼ü |
| ”” | D£® | øĆ·“Ó¦µÄÄÜĮæ×Ŗ»ÆŠĪŹ½Ö»ÄÜŅŌČČÄܵĊĪŹ½½ųŠŠ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ÉßĪĘŹÆÓÉMgO”¢Al2O3”¢SiO2”¢Fe2O3×é³É”£ĻÖČ”Ņ»·ŻÉßĪĘŹÆŹŌŃł½ųŠŠŹµŃ飬Ź×ĻČ½«ĘäČÜÓŚ
¹żĮæµÄŃĪĖį£¬¹żĀĖŗó£¬ŌŚĖłµĆµÄ³ĮµķXŗĶČÜŅŗYÖŠ·Ö±š¼ÓČėNaOHČÜŅŗÖĮ¹żĮ攣ĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ(””””)
A£®³ĮµķXµÄ³É·ÖŹĒSiO2
B£®½«ÉßĪĘŹÆŹŌŃłÖ±½ÓČÜÓŚ¹żĮæµÄNaOHČÜŅŗŗó¹żĀĖ£¬µĆµ½µÄ²»ČÜĪļĪŖFe2O3
C£®ŌŚČÜŅŗYÖŠ¼ÓČė¹żĮæµÄNaOHČÜŅŗ£¬¹żĀĖµĆµ½µÄ³ĮµķµÄÖ÷ŅŖ³É·ÖŹĒFe(OH)3ŗĶMg(OH)2
D£®ČÜŅŗYÖŠµÄŃōĄė×ÓÖ÷ŅŖŹĒMg2£«”¢Al3£«”¢Fe3£«”¢H£«
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
øßĢśµē³ŲŹĒŅ»ÖÖŠĀŠĶæɳäµēµē³Ų£¬µē½āÖŹČÜŅŗĪŖKOHČÜŅŗ£¬·ÅµēŹ±µÄ×Ü·“Ó¦Ź½ĪŖ£ŗ
3Zn£«2K2FeO4£«8H2O=3Zn(OH)2£«2Fe(OH)3£«4KOH”£ĻĀĮŠŠšŹöÕżČ·µÄŹĒ
A£®·ÅµēŹ±£¬Õż¼«ĒųČÜŅŗµÄpH¼õŠ”
B£®·ÅµēŹ±£¬øŗ¼«·“Ó¦Ź½ĪŖ3Zn£6e££«6OH£=3Zn(OH)2
C£®³äµēŹ±£¬Ćæ×ŖŅĘ3 molµē×Ó£¬Ńō¼«ÓŠ1 mol Fe(OH)3±»»¹Ō
D£®³äµēŹ±£¬µē³ŲµÄŠæµē¼«½ÓµēŌ“µÄÕż¼«
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŹµŃéŹŅĄūÓƵēŹÆŌü£ØÖ÷ŅŖŗ¬CaO”¢CaC2¼°ÉŁĮæC”¢SiO2£©ĪŖŌĮĻÖʱøĀČĖį¼ŲµÄŹµŃéĮ÷³Ģ¼°Ļą¹ŲĪļÖŹµÄČܽā¶ČČēĻĀ£ŗ
| ¼øÖÖĪļÖŹČܽā¶ČÓėĪĀ¶ČµÄ¹ŲĻµ | |||||
| ĪĀ¶Č | 0 | 10 | 20 | 30 | 40 |
| S(CaCl2)/g | 59.5 | 64.7 | 74.5 | 100 | 128 |
| S[Ca(ClO3)2]/g | 209 | ||||
| S(KClO3)/g | 3.3 | 5.2 | 7.3 | 10.2 | 13.9 |
£Ø1£© »Æ»Ņ³ŲÖŠCaC2ÓėĖ®·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ ”£
£Ø2£©ŌŚ80”ęĀČ»ÆŹ±²śÉśĀČĖįøĘ¼°ĀČ»ÆøʵĻÆѧ·½³ĢŹ½ĪŖ £»³żČ„ČÜŅŗÖŠ¶ąÓąµÄĀČĘųµÄ¼ņµ„·½·ØŹĒ ”£
£Ø3£©±„ŗĶKClČÜŅŗÄÜÓėĀČĖįøĘ·“Ó¦µÄŌŅņŹĒ ”£
£Ø4£©ĀĖŌüÖŠµÄ³É·ÖÖ÷ŅŖŹĒ £ØŠ“»ÆѧŹ½£©£»“Ó¹żĀĖŗóµÄČÜŅŗÖŠ»ńµĆKClO3¾§ĢåµÄ·½·ØŹĒ ”¢ ”¢Ļ“µÓ”¢ŗęøÉ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ijĪĀ¶ČĻĀ£¬Ļņ2 LŗćČŻĆܱÕČŻĘ÷ÖŠ³äČė1.0 mol A
ŗĶ1.0 mol B£¬·“Ó¦ ¾¹żŅ»¶ĪŹ±¼äŗó“ļµ½Ę½ŗā”£·“Ó¦¹ż³ĢÖŠ²ā¶ØµÄ²æ·ÖŹż¾Ż¼ūĻĀ±ķ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
¾¹żŅ»¶ĪŹ±¼äŗó“ļµ½Ę½ŗā”£·“Ó¦¹ż³ĢÖŠ²ā¶ØµÄ²æ·ÖŹż¾Ż¼ūĻĀ±ķ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
| t£Æs | 0 | 5 | 15 | 25 | 35 |
| n(A)£Æmol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A”¢·“Ó¦ŌŚĒ°5 sµÄĘ½¾łĖŁĀŹ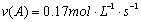
B”¢±£³ÖĘäĖūĢõ¼ž²»±ä£¬ÉżøßĪĀ¶Č£¬Ę½ŗāŹ± £¬Ōņ·“Ó¦µÄ
£¬Ōņ·“Ó¦µÄ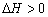
C”¢ĻąĶ¬ĪĀ¶ČĻĀ£¬ĘšŹ¼Ź±ĻņČŻĘ÷ÖŠ³äČė2.0 mol C“ļµ½Ę½ŗāŹ±£¬CµÄ×Ŗ»ÆĀŹ“óÓŚ80£„
D”¢ĻąĶ¬ĪĀ¶ČĻĀ£¬ĘšŹ¼Ź±ĻņČŻĘ÷ÖŠ³äČė0.20 mol A”¢0.20 mol BŗĶ1.0 mol C£¬·“Ó¦“ļµ½Ę½ŗāĒ°
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŌŚŅ»¶ØĢõ¼žĻĀ£¬½«PCl3(g)ŗĶCl2(g)³äČėĢå»ż
²»±äµÄ2LĆܱÕČŻĘ÷ÖŠ·¢ÉśĻĀŹö·“Ó¦£ŗPCl3(g) £«Cl2(g) 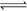 PCl5(g)£»5minÄ©“ļµ½Ę½ŗā£¬ÓŠ¹ŲŹż¾ŻČēĻĀ±ķ”£
PCl5(g)£»5minÄ©“ļµ½Ę½ŗā£¬ÓŠ¹ŲŹż¾ŻČēĻĀ±ķ”£
| PCl3(g) | Cl2(g) | PCl5(g) | |
| ³õŹ¼ÅØ¶Č£Ømol•L—1£© | 2.0 | 1.0 | 0 |
| Ę½ŗāÅØ¶Č£Ømol•L—1£© | C1 | C2 | 0.4 |
ĻĀĮŠÅŠ¶Ļ²»ÕżČ·µÄŹĒ
A£®ČōÉżøßĪĀ¶Č£¬·“Ó¦µÄĘ½ŗā³£Źż¼õŠ”£¬ŌņÕż·“Ó¦ĪŖĪüČČ
B£®·“Ó¦5minÄŚ£¬v(PCl3)=0.08 mol•L-1•min-1
C£®µ±ČŻĘ÷ÖŠCl2ĪŖ1.2molŹ±£¬æÉÄę·“Ó¦“ļµ½Ę½ŗāדĢ¬
D£®Ę½ŗāŗóŅĘ×ß2.0mol PCl3ŗĶ1.0mol Cl2£¬ŌŚĻąĶ¬Ģõ¼žĻĀŌŁ“ļĘ½ŗāŹ±£¬c(PCl5)<0.2 mol•L-1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŌŚÄ³100 mLµÄ»ģŗĻŅŗÖŠ£¬ĻõĖįŗĶĮņĖįµÄĪļÖŹµÄĮæÅØ¶Č·Ö±šŹĒ0.4 mol/L”¢0.1 mol/LĻņøĆ»ģŗĻŅŗÖŠ¼ÓČė1.92 gĶ·Ū£¬¼ÓČČ£¬“ż³ä·Ö·“Ó¦ŗó£¬ĖłµĆČÜŅŗÖŠĶĄė×ÓµÄĪļÖŹµÄĮæÅØ¶ČŹĒ(””””)
A£®0.15 mol/L”””””””””” B£®0.225 mol/L
C£®0.30mol/L D£®0.45 mol/L
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
¾§Ģå¹čŹĒŅ»ÖÖÖŲŅŖµÄ·Ē½šŹō²ÄĮĻ£¬Öʱø“æ¹čµÄÖ÷ŅŖ²½ÖčČēĻĀ£ŗ
¢ŁøßĪĀĻĀÓĆĢ¼»¹Ō¶žŃõ»Æ¹čÖĘµĆ“Ö¹č
¢Ś“Ö¹čÓėøÉŌļHClĘųĢå·“Ó¦ÖʵĆSiHCl3£ŗSi£«3HCl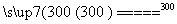 SiHCl3£«H2
SiHCl3£«H2
¢ŪSiHCl3Óė¹żĮæH2ŌŚ1 000”«1 100 ”ę·“Ó¦ÖʵƓæ¹č”£
ŅŃÖŖSiHCl3ÄÜÓėH2OĒæĮŅ·“Ó¦£¬ŌŚæÕĘųÖŠŅ××ŌČ¼”£
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)µŚ¢Ł²½Öʱø“Ö¹čµÄ»Æѧ·“Ó¦·½³ĢŹ½ĪŖ_____________________________”£
(2)“Ö¹čÓėHCl·“Ó¦ĶźČ«ŗ󣬾ĄäÄżµĆµ½µÄSiHCl3(·Šµć£33 ”ę)ÖŠŗ¬ÓŠÉŁĮæSiCl4(·Šµć57.6 ”ę)ŗĶHCl(·Šµć£84.7 ”ę)£¬Ģį“æSiHCl3²ÉÓƵķ½·ØĪŖ________”£
(3)ÓĆSiHCl3Óė¹żĮæH2·“Ó¦Öʱø“æ¹čµÄ×°ÖĆČēĻĀĶ¼(ČČŌ“¼°¼Š³Ö×°ÖĆĀŌČ„)

¢Ł×°ÖĆBÖŠµÄŹŌ¼ĮŹĒ________”£×°ÖĆCÖŠµÄÉÕĘæŠčŅŖ¼ÓČČ£¬ĘäÄæµÄŹĒ_________________________”£
¢Ś·“Ó¦Ņ»¶ĪŹ±¼äŗó£¬×°ÖĆDÖŠ¹Ū²ģµ½µÄĻÖĻóŹĒ________£¬×°ÖĆD²»ÄܲÉÓĆĘÕĶز£Į§¹ÜµÄŌŅņŹĒ____________________________”£
×°ÖĆDÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_____________________________”£
¢ŪĪŖ±£Ö¤Öʱø“æ¹čŹµŃéµÄ³É¹¦£¬²Ł×÷µÄ¹Ų¼üŹĒ¼ģ²éŹµŃé×°ÖƵÄĘųĆÜŠŌ£¬æŲÖĘŗĆ·“Ó¦ĪĀ¶ČŅŌ¼°_________________________”£
¢ÜĪŖ¼ų¶Ø²śĘ·¹čÖŠŹĒ·ńŗ¬Ī¢ĮæĢśµ„ÖŹ£¬½«ŹŌŃłÓĆĻ”ŃĪĖįČܽā£¬Č”ÉĻ²ćĒåŅŗŗóŠčŌŁ¼ÓČėµÄŹŌ¼ĮŹĒ(ĢīŠ“×ÖÄø“śŗÅ)________”£
a£®µāĖ®”” b£®ĀČĖ® ””c£®NaOHČÜŅŗ ””d£®KSCNČÜŅŗ e£®Na2SO3ČÜŅŗ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com