
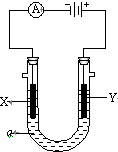
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:分析 (1)若X、Y都是惰性电极,a是饱和NaCl溶液,和电源的正极相连的Y电极为阳极,氯离子放电生成氯气,和电源的负极相连的电极X极是阴极,氢离子放电,同时该电极附近生成氢氧根离子;
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,阳极应该是粗铜、阴极是纯铜,则X电极是纯铜、Y电极是粗铜,阴极上铜离子放电,阳极是铜失电子被氧化成铜离子进入溶液中;
(3)如要在铁上镀银,电解液选用硝酸银,阳极应该是Ag、阴极是Fe,则X电极是Fe、Y电极是Ag,阴极上银离子放电,阳极是银失电子被氧化成银离子进入溶液中.
解答 解:(1)若X、Y都是惰性电极,a是饱和NaCl溶液,和电源的正极相连的Y电极为阳极,氯离子放电生成氯气,电极反应式为2Cl--2e-=Cl2↑,和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,电解化学方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:①2Cl--2e-=Cl2↑;②2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,阳极应该是粗铜、阴极是纯铜,则与电源负极相连的阴极X是纯铜,阴极是铜离子放电,电极反应式为Cu2++2e-=Cu,与电源正极相连的阳极Y是粗铜,阳极发生反应为:Cu-2e-=Cu2+,
故答案为:①纯铜; Cu2++2e-=Cu;②粗铜;Cu-2e-=Cu2+;
(3)如要在铁上镀银,电解液选用硝酸银,阳极应该是Ag、阴极是Fe,则与电源负极相连的阴极X电极是Fe,电极反应式为Ag++e-=Ag,与电源正极相连的阳极Y是银,阳极发生反应为:Ag-e-=Ag+,故答案为:①铁;Ag++e-=Ag;②银;Ag-e-=Ag+.
点评 本题考查原电池原理,为高频考点,侧重于学生的分析能力的考查,本题涉及电极反应式的书写等知识点,注意离子放电顺序及电极反应式的书写,题目难度不大.


 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O中所含原子总数为NA | |
| B. | 质量均为7.8 g的Na2S、Na2O2固体中含有的阴离子数均为0.1NA | |
| C. | 标准状况下,2.24 L Cl2通入足量H2O,转移的电子数均为0.1NA | |
| D. | 常温下,浓度为0.01mol/L的Na2CO3溶液中CO32-的数目为0.01 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳-12的原子符号:12 6C | |
| B. | 次氯酸分子的结构式:H-O-Cl | |
| C. | 硫离子的电子排布式为:1s22s22p63s23p6 | |
| D. | 二氧化硅的分子式:SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
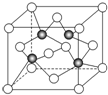 已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增.B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3P轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体.根据以上信息,回答下列问题:
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增.B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3P轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体.根据以上信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
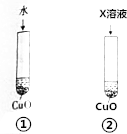 氧化铜可溶于稀硫酸,某同学为探究稀硫酸中的哪种粒子(H2O、H+、SO42-)使氧化铜溶解设计了如下实验.
氧化铜可溶于稀硫酸,某同学为探究稀硫酸中的哪种粒子(H2O、H+、SO42-)使氧化铜溶解设计了如下实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com