
【题目】以环己醇为原料制取己二酸[HOOC(CH2)4COO H]的实验流程如下:
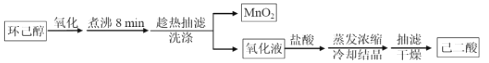
其中“氧化”的实验过程:在250mL四颈烧瓶中加入50 mL水和3.18g碳酸钠,低速搅拌至碳酸钠溶解,缓慢加入9.48g(约0.060 mol)高锰酸钾,按图示搭好装置:
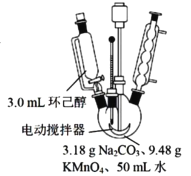
打开电动搅拌,加热至35℃,滴加3.2 mL(约 0.031 mol) 环己醇,发生的主要反应为:![]()
![]() KOOC(CH2)4COOK H<0
KOOC(CH2)4COOK H<0
(1)“氧化”过程应采用____________加热
(2)“氧化”过程为保证产品纯度需要控制环己醇滴速的原因是:_______________。
(3)为证明“氧化”反应已结束,在滤纸上点1滴混合物,若观察到___________则表明反应已经完成。
(4)“趁热抽滤”后,用___________进行洗涤(填“热水”或“冷水")。
(5)室温下,相关物质溶解度如表:
化学式 | 己二酸 | NaCl | KCl |
溶解度g/100g水 | 1.44 | 35.1 | 33.3 |
“蒸发浓缩”过程中,为保证产品纯度及产量,应浓缩溶液体积至_________(填标号)
A.5mL B.10mL C.15mL D.20mL
(6)称取己二酸(Mr-=146 g/mol)样品0.2920 g,用新煮沸的50 mL 热水溶解,滴入2滴酚酞试液,用0.2000 mol/L NaOH 溶液滴定至终点,消耗 NaOH 的平均体积为 19.70 mL。NaOH 溶液应装于____________(填仪器名称),己二酸样品的纯度为________。
【答案】水浴 为保证反应温度的稳定性(小于50℃)或控制反应温度在50℃以下 未出现紫红色 热水 C 碱式滴定管 98.5%
【解析】
由题意可知,三颈烧瓶中加入3.18克碳酸钠和50mL水,低温搅拌使其溶解,然后加入9.48g高锰酸钾,小心预热溶液到35℃,缓慢滴加3.2mL环己醇,控制滴速,使反应温度维持在45℃左右,反应20min后,再在沸水浴上加热5min促使反应完全并使MnO2沉淀凝聚,加入适量亚硫酸氢钠固体除去多余高锰酸钾,趁热过滤得到MnO2沉淀和含有己二酸钾的滤液,用热水洗涤MnO2沉淀,将洗涤液合并入滤液,热浓缩使滤液体积减少至10mL左右,趁热小心加入浓硫酸,使溶液呈强酸性(调节pH=1~2),冷却结晶、抽滤、洗涤、干燥,得己二酸白色晶体;
(1)氧化过程需要使反应温度维持在35℃左右;
(2)因为滴速对溶液的温度有影响,为保证产品纯度,需要控制反应温度;
(3)为证明“氧化”反应已结束,就是检验无高锰酸钾即可;
(4)根据减少物质的损失,结合物质溶解度与温度的关系分析;
(5)室温下,根据相关物质溶解度,“蒸发浓缩”过程中,要保证产品纯度及产量,就是生成的杂质要依然溶解在溶液中,据此计算应浓缩溶液体积;
(6)①根据仪器的特点和溶液的性质选取仪器;
②称取已二酸(Mr=146g/mol)样品0.2920g,用新煮沸的50mL热水溶解,滴入2滴酚酞试液,用0.2000mol/L NaOH溶液滴定至终点,进行平行实验及空白实验后,消耗NaOH的平均体积为19.70mL;设己二酸样品的纯度为ω,根据HOOC(CH2)4COOH~2NaOH计算。
(1)氧化过程需要使反应温度维持在35℃左右,要用35℃的热水浴;
(2)因为滴速对溶液的温度有影响,为保证反应温度的稳定性(小于50℃)或控制反应温度在50℃以下,需要控制环己醇滴速;
(3)为证明“氧化”反应已结束,就是检验无高锰酸钾即可,所以在滤纸上点1滴混合物,若观察到未出现紫红色,即表明反应完全;
(4)根据步骤中分析可知要使生成的MnO2沉淀并充分分离MnO2沉淀和滤液,应趁热过滤;为减少MnO2沉淀的损失,洗涤时也要用热水洗涤;
(5)据题意,高锰酸钾约0.060mol,碳酸钠3.18g,0.030mol,根据元素守恒,得最后NaCl、KCl最多为0.060mol,质量分别为3.51g,4.47g,所需体积最少要10mL、13.4mL,为确保产品纯度及产量,所以应浓缩溶液体积至15mL;
(6)①氢氧化钠溶液呈碱性,需要的仪器是碱式滴定管;
②称取已二酸(Mr=146g/mol)样品0.2920g,用新煮沸的50mL热水溶解,滴入2滴酚酞试液,用0.2000mol/L NaOH溶液滴定至终点,进行平行实验及空白实验后,消耗NaOH的平均体积为19.70mL;设己二酸样品的纯度为ω,则:
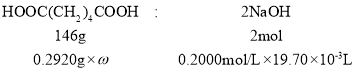
![]() =
=![]()
解得ω=98.5%.


科目:高中化学 来源: 题型:
【题目】为了探究铁、铜及其化合物的性质,某同学设计并进行了下列两组实验。
实验一:
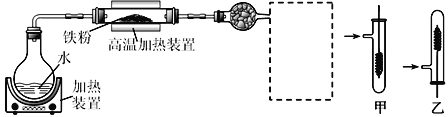
(1)写出在高温加热装置中发生的反应的化学方程式___________
(2)虚线框处宜选择的装置是_____(填“甲”或“乙”);实验时应先将螺旋状铜丝加热,变黑后再趁热迅速伸入所制得的纯净氢气中,观察到的实验现象是_________________。
(3)实验后,为检验硬质玻璃管中的固体是否含+3价的铁元素,该同学取一定量的固体并用一定浓度的盐酸溶解,滴加_________溶液(填试剂名称或化学式),没有出现血红色,说明该固体中没有+3价的铁元素。请你判断该同学的结论是否正确并说明理由________
实验二:绿矾是含有一定量结晶水的硫酸亚铁,为测定绿矾中结晶水含量,将石英玻璃管(带两端开关![]() 和
和![]() ,设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g,B为干燥管。按图连接好装置进行实验。
,设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g,B为干燥管。按图连接好装置进行实验。

实验步骤如下:(1)_______,(2)点燃酒精灯,加热,(3)________,(4)_______,(5)________,(6)称量A,重复上述操作步骤,直至A恒重,记为m3g。
(4)请将下列实验步骤的编号填写在对应步骤的横线上。
a. 关闭![]() 和
和![]() b. 熄灭酒精灯 c. 打开
b. 熄灭酒精灯 c. 打开![]() 和
和![]() 缓缓通入
缓缓通入![]() d. 冷却至室温
d. 冷却至室温
(5)必须要进行恒重操作的原因是_______________。
(6)已知在上述实验条件下,绿矾受热只是失去结晶水,硫酸亚铁本身不会分解,根据实验记录,计算绿矾化学式中结晶水数目X=____________(用含m1、m2、m3的列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过学习,同学们对宏观辨识与微观探析,变化观念与平衡思想等学科素养有了进一步的认识和理解。请根据所学知识回答下列问题:
(1)铅蓄电池是典型的可充电型电池,电池总反应式为:Pb+PbO2+4H++2SO42-![]() 2PbSO4 +2H2O。放电时,负极的电极反应式是_______;充电时,当外电路通过 0.2 mol 电子时,理论上正极板的质量减少_________g。
2PbSO4 +2H2O。放电时,负极的电极反应式是_______;充电时,当外电路通过 0.2 mol 电子时,理论上正极板的质量减少_________g。
(2)已知:常温下,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4×10-38。
①常温下,某酸性 MgCl2 溶液中含有少量的 FeCl3 ,为了得到纯净的 MgCl2·2H2O 晶体,应加入_________填化学式),调节溶液的 pH=4,使溶液中的 Fe3+转化为 Fe(OH)3沉淀,此时溶液中的 c(Fe3+)=_________mol·L-1。
②常温下,若将 0.01 mol·L-1 MgCl2 溶液与至少________mol·L-1 NaOH 溶液等体积混合时有沉淀生成。
(3)25℃时,几种离子开始沉淀时的 pH 如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度 Cu2+、Mg2+、Fe2+的溶液中滴加 NaOH 溶液时,__________先沉淀(填离子符号),要使 0.3mol·L-1 硫酸铜溶液中Cu2+沉淀较为完全(当 Cu2+浓度降至 10-5 mol·L-1时),则应向溶液里加入氢氧化钠溶液使溶液 pH 为________(KspCu(OH)2=1×10-20)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.20 mol/LKMnO4酸性溶液 0.l0L与一定量pH=3.0的草酸(HOOC-COOH)溶液混合,放出VL气体。NA表示阿伏加德罗常数的值,下列说法正确的是
A.9 g HOOC-COOH含共用电子对数目为0.9NA
B.当0.01mol KMnO4 被还原时,强酸提供的H+数目为 0.01NA
C.pH=3.0的草酸溶液含有H+数目为0.001NA
D.该反应释放 CO2分子数目为VNA/22.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某Na2CO3、NaHCO3的混合溶液中加入少量的BaCl2,测得溶液中![]() 与
与![]() 的关系如图所示,下列说法正确的是
的关系如图所示,下列说法正确的是
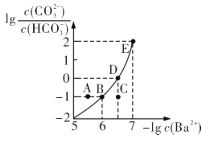
A.该溶液中![]()
B.B、D、E三点对应溶液pH的大小顺序为B>D>E
C.A、B、C三点对应的分散系中,A点的稳定性最差
D.D点对应的溶液中一定存在2c(Ba2+ ) +c(Na+ )+c(H+ )=c(CO32- )+c(OH- )+c(Cl- )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )

A.该混合溶液中c(HA)+c(A-)=c(Na+)
B.该混合液pH=7
C.图中x表示HA,Y表示OH-,Z表示H+
D.HA是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T1温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)![]() 2NO2(g) H<0。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如下表:
2NO2(g) H<0。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
(1)从0~2s该反应的平均速率v(NO2)=__。
(2)T1温度时化学平衡常数K=__L·mol-1。
(3)化学平衡常数K与速率常数k正、k逆的数学关系是K=__。若将容器的温度改变为T2时其k正=k逆,则T2__T1(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将反应![]() 设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )
设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )

A.![]() 盐桥中的
盐桥中的![]() 移向
移向![]() 溶液
溶液
B.![]() 作负极,发生还原反应
作负极,发生还原反应
C.若将盐桥换成银丝,工作一段时间后,![]() 溶液中
溶液中![]() 减小
减小
D.若将盐桥换成银丝,当锌电极质量减少![]() ,银电极质量增加
,银电极质量增加![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用氯酸钠(NaClO3)为原料制取,(常温下ClO2为气态),下列说法错误的是
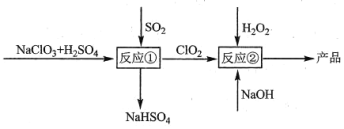
A.反应①阶段,参加反应的NaClO3和SO2的物质的量之比为2:1
B.反应①后生成的气体要净化后进入反应②装置
C.升高温度,有利于反应②提高产率
D.反应②中有气体生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com