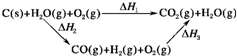将煤转化为水煤气的主要化学反应为:
C+H
2O
CO+H
2C(s)、CO(g)和H
2(g)完全燃烧的热化学方程式为:
C(s)+O
2(g)═CO
2(g)△H=-393.5kJ?mol
-1H
2(g)+
O
2(g)═H
2O(g)△H=-242.0kJ?mol
-1CO(g)+
O
2(g)═CO
2(g)△H=-283.0kJ?mol
-1请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:
C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJ?mol-1
C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJ?mol-1
.
(2)比较反应热数据可知,1mol CO(g)和1mol H
2(g)完全燃烧放出的热量之和比1mol C(s)完全燃烧放出的热量多.甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律作出下列循环图(见图):
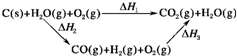
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”.
请分析:甲、乙两同学观点正确的是
乙
乙
(填“甲”或“乙”);判断的理由是
甲同学忽略了煤转化为水煤气要吸收热量(或△H1=△H2+△H3且△H2>0)
甲同学忽略了煤转化为水煤气要吸收热量(或△H1=△H2+△H3且△H2>0)
.
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点
减少污染
减少污染
,
燃烧充分
燃烧充分
.
(4)水煤气不仅是优良的气体燃料,也是重要的有机化工原料.
CO和H
2在一定条件下可以合成:①甲醇、②甲醛、③甲酸、④乙酸.
试分析当CO和H
2按1:1的体积比混合反应,合成上述
②④
②④
(填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放.