


科目:高中化学 来源: 题型:
| A、0.5mol?L-1 |
| B、1.0mol?L-1 |
| C、1.5mol?L-1 |
| D、2.0mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
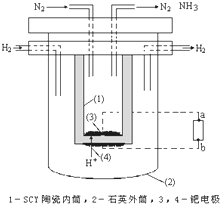 合成氨工业对国民经济和社会发展具有重要的意义.其原理为:
合成氨工业对国民经济和社会发展具有重要的意义.其原理为:查看答案和解析>>
科目:高中化学 来源: 题型:
2- x |
- 3 |
2- 4 |
- 3 |
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试剂 | 操作步骤 | 发生现象 | 结论 | |
| ①氢氧化铜 |
a.将尿液与试剂混合振荡 | 甲.蓝色溶液 | ||
| 乙.生成绿色沉淀 |
||||
| ②斐林试剂 |
b.将尿液与试剂混合后加热至沸腾 | |||
| 丙.生成黄绿色沉淀 | ||||
| ③硫酸铜 | c.将尿液与试剂混合后微热 |
丁.生成黄色沉淀 | ||
| 戊.生成砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com