
| A. | 8:3 | B. | 2:3 | C. | 3:4 | D. | 3:8 |
分析 1mol硫酸钠中含有2mol钠离子和1mol硫酸根离子,1mol氯化镁中含有1mol镁离子和2mol氯离子,依据c(SO42-):c(Cl-)=2:3,计算硫酸钠、氯化镁物质的量,进而计算钠离子与镁离子的物质的量,据此解答.
解答 解:该溶液中的溶质是硫酸钠和氯化镁,化学式分别Na2SO4和MgCl2,因c(SO42-):c(Cl-)=2:3,设硫酸根离子物质的量为4mol,则氯离子物质的量为6mol,则硫酸钠物质的量为4mol,氯化镁物质的量为3mol,4mol硫酸钠含有钠离子物质的量为4mol×2=8mol,3mol氯化镁含有镁离子物质的量为3mol,所以c(Cl-):c(Mg2+)=8:3;
故选:A.
点评 本题考查了微粒个数计算,明确硫酸钠和氯化镁中阴阳离子个数配比是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 上述两种溶液分别用水稀释m、n倍,溶液的pH都变成3,则m>n | |
| B. | 上述两种溶液分别与足量的Zn完全反应,产生的H2一样多 | |
| C. | 上述两种溶液分别与等浓度的氢氧化钠溶液恰好反应,消耗氢氧化钠溶液的体积相同 | |
| D. | 1mol/L的盐酸和1mol/L的醋酸的混合溶液与氢氧化钠溶液恰好完全反应时,反应后溶液中c(CH3COO-)+C(Cl-)<c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ②⑦ | C. | ①③ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
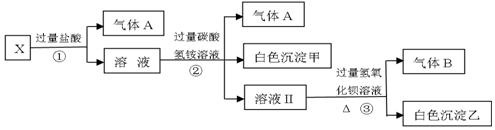
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
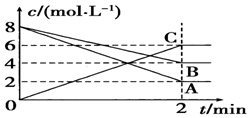 某温度时,在2L密闭容器中,某一化学反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:
某温度时,在2L密闭容器中,某一化学反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com