
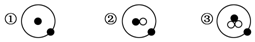
 ”表示中子.
”表示中子.分析 (1)从图示知①、②、③中的质子数等于电子数且都等于1,可知①②③代表的微粒分别为11H、12H、13H,质子数相同中子数不同,互为同位素,据此进行解答;
(2)H3和H2的摩尔质量分别为3g/mol、2g/mol,结合n=$\frac{m}{M}$可知,等质量时物质的量不同,但H原子的质量相同,以此来解答.
(3)质量数=质子数+中子数,核外电子数=质子数+所带电荷数,根据n=$\frac{m}{M}$计算出其物质的量,然后根据N=nNA计算出含有电子数;
(4)结合n=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$进行计算.
解答 解:(1)从图示知①、②、③中的质子数等于电子数且都等于1,可知①②③代表的微粒分别为11H、12H、13H,质子数相同中子数不同,互为同位素,
A.①、②、③表示的都是氢原子,为同种元素的原子,故A正确;
B.①②③代表的微粒分别为11H、12H、13H,质子数相同中子数不同,互为同位素,故B正确;
C.三个图形中均含有1个质子,都是氢元素,同种元素的原子化学性质相同,故C错误;
D.H、D、T是氢元素的三种不同原子即三种核素,11H、12H、13H质量数分别为1、2、3,其质量数不相同,故D错误;
故选C.
故答案为:B;
(2)H3和H2的摩尔质量分别为3g/mol、2g/mol,结合n=$\frac{m}{M}$可知,等质量时物质的量不同,含有H原子的物质的量相等,
A.等质量的H3和H2,H原子的质量相同,则H原子数目相同,故A正确;
B.二者物质的量不同,由N=nNA可知,分子数不同,故B错误;
C.物质的量不同,由V=nVm可知,则体积不同,故C错误;
D.等质量时具有相同物质的量的H,则含有的电子数相同,故D正确;
故答案为:AD;
(3)对应微粒R3+来说,质量数=质子数+中子数,核外电子数=质子数+所带电荷数,所以该离子的核外电子数=质量数-中子数+所带电荷数=A-N+3,mg该离子的物质的量为:$\frac{mg}{Ag/mol}$=$\frac{m}{A}$mol,含有电子的数目为:$\frac{m}{A}$×(A-N+3)×NA=$\frac{m(A-N+3){N}_{A}}{A}$,
故答案为:$\frac{m(A-N+3){N}_{A}}{A}$.
(4)①6.72L CH4气体,其物质的量为:$\frac{6.72L}{22.4L/mol}$=0.3mol,其质量为0.3mol×16g/mol=4.8g;
②3.01×1023个HCl气体分子物质的量为:0.5mol,质量为0.5mol×36.5g/mol=18.25g;
③13.6g H2S气体,其物质的量为:$\frac{13.6g}{34g/mol}$=0.4mol;
④0.2mol NH3,其质量为0.2mol×17g/mol=3.4g;
①标况下,气体的物质的量大的体积大,则体积从大到小为②③①④,
故答案为:②>③>①>④;
②四种气体的质量从大到小为②③①④,
故答案为;②>③>①>④.
点评 本题考查了物质的量的计算,题目难度中等,明确物质的量与其它物理量之间的关系即可解答,试题培养了学生的分析能力及化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用V(X)和V(Y)表示此反应的反应速率是:V(X)=V(Y)=(0.1-0.2a)mol•(L•min)-1 | |
| B. | 当混合气体的质量不再发生变化时,说明反应达到平衡状态,此时气体总量为(1+n)mol | |
| C. | 若建立平衡I的起始时n=1,维持温度和体积不变,向平衡I的体系中再加入cmolZ和dmolM[其中c>0的任意值,d≥(1-a)mol],达到平衡状态II,此时Y的体积分数一定为w% | |
| D. | 维持温度和体积不变,向上述平衡体系中再充入l mol X和n mol Y,此时v(正)增大,v(逆)减小,平衡正向移动,再次达到平衡时,Z的物质的量浓度为2a mol/L,M的物质的量为2a mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数B>A>C | B. | 原子最外层电子数C>A>B | ||
| C. | 原子半径A>C>B | D. | 离子半径A+>B2->C3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解得到的 Cu 的物质的量为 0.5 mol | |
| B. | 向电解后的溶液中加入 98 g 的 Cu(OH)2 可恢复为原溶液 | |
| C. | 原混合溶液中 c(K+)=4 mol/L | |
| D. | 电解后溶液中 c(H+)=2 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com