

| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、离子半径:T>W |
| B、最高价氧化物对应水化物的酸性:Q>W>G |
| C、最简单气态氢化物的热稳定性:Q<R |
| D、T和G组成的化合物甲溶于水,其水溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
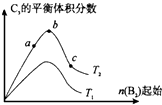 已知2A2(g)+B2(g)?2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol?L-1,放出热量为Q2 kJ.
已知2A2(g)+B2(g)?2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol?L-1,放出热量为Q2 kJ.查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | A | B | C | D |
| 强电解质 | KNO3 | H2SO4 | BaSO4 | HClO4 |
| 弱电解质 | HF | CaCO3 | HClO | CH3COONH4 |
| 非电解质 | SO2 | 金属Al | H2O | C2H5OH |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蛋白质在体内经消化后生成碳酸、硫酸、尿酸等,故它属于酸性食物 |
| B、葡萄吃起来是酸的,故它属于酸性食物 |
| C、食物的酸碱性与化学上所指溶液的酸碱性不同的 |
| D、正常情况下,人体血液的pH总保持弱碱性范围 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com