
科目:高中化学 来源: 题型:选择题
| A. | 该反应是复分解反应 | B. | NO发生还原反应 | ||
| C. | CO是氧化剂 | D. | 反应物中O得电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
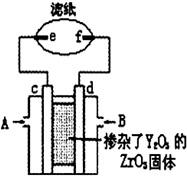 向新型燃料电池的两极分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传到O2-,图中滤纸用含有酚酞的氯化钠溶液浸泡过,c、d、e、f均为惰性电极,工作后e极周围变红,下列叙述正确的是( )
向新型燃料电池的两极分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传到O2-,图中滤纸用含有酚酞的氯化钠溶液浸泡过,c、d、e、f均为惰性电极,工作后e极周围变红,下列叙述正确的是( )| A. | c极为正极,A处通入甲烷气体 | B. | d极的反应式为O2+2H2O+4e-=4OH- | ||
| C. | 固体电解质中O2-由d极向c极移动 | D. | e极上发生氧化反应,pH上升 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
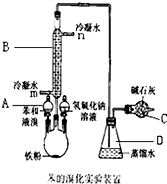 实验室用图装置制取少量溴苯,试填写下列空白.
实验室用图装置制取少量溴苯,试填写下列空白.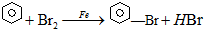 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 | B. | 1.0 mol•L-1 | C. | 0.3 mol•L-1 | D. | 0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和BaCl2溶液 阴极:Ba2++2e-=Ba | |
| B. | 电解Cu(NO3)2溶液 阴极:Cu2++2e-=Cu | |
| C. | 电解熔融NaCl阴极:Na++e-=Na | |
| D. | 电解NaOH溶液 阳极:4OH--4e-=2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
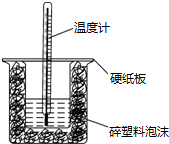 中和热是在稀溶液中,酸和碱反应生成1mol水所放出的热量.某同学利用50mL 0,.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和热测定的实验,回答下列问题:
中和热是在稀溶液中,酸和碱反应生成1mol水所放出的热量.某同学利用50mL 0,.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和热测定的实验,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com