
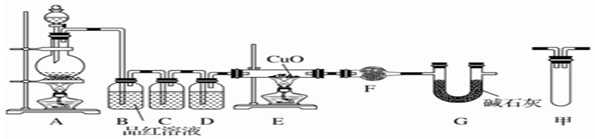
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | 液溴 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 | 红色发烟液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 | 3.12 |
| 沸点/℃ | 78.5 | 132 | 34.6 | 58.8 |
| 熔点/℃ | -l30 | 9 | -1l6 | -7.2 |
分析 (1)乙醇在浓硫酸做催化剂、脱水剂条件下加热到140度发生副反应生成乙醚;
(2)浓硫酸具有脱水性,强氧化性,能够与乙醇脱水生成的碳发生氧化还原反应生成二氧化硫、二氧化碳气体,二者为酸性氧化物能够与碱液反应;
(3)溴水为橙黄色,如果完全反应生成的1,2-二溴乙烷无色;
(4)1,2-二溴乙烷密度大于水,不溶于水;
(5)要出去1,2-二溴乙烷中的溴,应选择能够与溴反应或者溶解溴而不溶解1,2-二溴乙烷或者与1,2-二溴乙烷反应的物质;
(6)依据乙醚与1,2-二溴乙互溶,二者熔沸点不同选择分离方法;
(7)乙烯与溴反应时放热,冷却可避免溴的大量挥发,但不能过度冷却(如用冰水),否则使气路堵塞.
解答 解:(1)乙醇在浓硫酸做催化剂、脱水剂条件下加热到140度发生副反应生成乙醚,所以要制备乙烯应尽可能快地把反应温度提高到170℃,减少副产物乙醚的生成;
故选:c;
(2)浓硫酸具有脱水性,强氧化性,能够与乙醇脱水生成的碳发生氧化还原反应生成二氧化硫、二氧化碳气体,二者为酸性氧化物能够与碱液反应,为除去乙烯中的二氧化硫、二氧化碳气,应选择碱性溶液;
a.二氧化碳水溶性较细,吸收不充分,故a不选;
b.二氧化碳、二氧化硫与浓硫酸不反应,不能用浓硫酸吸收,故b不选;
c.碳酸氢钠不能吸收二氧化碳,故c不选;
d.二氧化硫、二氧化碳气为酸性氧化物,能够与氢氧化钠溶液反应而被吸收,故d选;
故选:d;
(3)溴水为橙黄色,如果完全反应生成的1,2-二溴乙烷无色,所以可以通过观察D中溴水是否完全褪色判断制备反应已经结束;
故答案为:溴水完全褪色;
(4)1,2-二溴乙烷密度大于水,不溶于水,所以:将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层;
故答案为:下;
(5)a.溴更易溶于1,2-二溴乙烷,用水无法除去溴,故a不选;
b.酒精与1,2-二溴乙烷互溶,不能除去混有的溴,故b不选;
c.NaI与溴反应生成碘,碘与1,2-二溴乙烷互溶,不能分离,故c不选;
d.常温下Br2和氢氧化钠发生反应:2NaOH+Br2═NaBr+NaBrO+H2O,再分液除去,但1,2-二溴乙烷在氢氧化钠水溶液、加热条件下容易发生水解反应,低温下,可用氢氧化钠出去溴杂质,故d选;
故选:d;
(6)乙醚与1,2-二溴乙互溶,二者熔沸点不同选择,应用蒸馏的方法分离二者;
故答案为:蒸馏;
(7)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,否则会使产品凝固而堵塞导管;
故答案为:避免溴大量挥发;产品1,2-二溴乙烷的熔点低,过度冷却会凝固而堵塞导管.
点评 本题考查有机物合成实验,主要考查了乙醇制备1,2-二溴乙烷,涉及制备原理、物质的分离提纯、实验条件控制、对操作分析评价等,是对基础知识的综合考查,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Fe 2+、CH 3COOˉ、SO 42ˉ、Na + | B. | Ca 2+、K +、Cl-、HCO 3- | ||
| C. | NH 4+、Al 3+、NO 3-、Cl- | D. | K +、Na +、SO 32-、AlO 2- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验目的 | 试剂及方法 |
| 证明某地雨水呈酸性 | A |
| 检验自来水中是否含有Cl- | C |
| 除去FeCl2溶液中的少量FeCl3 | B |
| 除去Fe2O3中的Al2O3 | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②④ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏、石油的分馏是物理变化 | B. | 煤的液化、石油的裂化是化学变化 | ||
| C. | 天然气的主要成分是甲烷 | D. | 三者均属于不可再生的能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg$?_{充电}^{放电}$3Fe+4MgS,装置如图所示.下列说法不正确的是( )
一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg$?_{充电}^{放电}$3Fe+4MgS,装置如图所示.下列说法不正确的是( )| A. | 放电时,电路中转移0.5mol电子则阴离子交换膜上移动0.25mol S2- | |
| B. | 放电时,正极的电极反应式为Fe3S4+8e-=3Fe+4S2- | |
| C. | 充电时,阴极的电极反应式为MgS+2e-=Mg+S2- | |
| D. | 充电时,S2-从阴离子交换膜左侧向右侧迁移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com