
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式,反应的热化学方程式改变系数,焓变随之改变,通过热化学方程式之间的加减计算得到;
(2)负极通入丙烷,碳元素的化合价升高,电池的正极通入O2,氧元素的化合价降低,丙烷与氧气反应生成二氧化碳和水,以此来书写电池反应方程式;原电池中阴离子向负极移动;惰性电极电解1000mL1mol/L的AgNO3溶液,反应生成氧气和银,硝酸,据此书写反应方程式.
解答 解:(1)已知:①2C3H8(g)+7O2(g)═6CO(g)+8H2O(l)△H1
②C(s)+O2(g)═CO2(g)△H2
③2C(s)+O2(g)═2CO(g)△H3
依据盖斯定律:①×$\frac{1}{2}$+②×3-③×$\frac{3}{2}$得到:C3H8(g)+5O2((g)═3CO2(g)+4H2O(l)△H=($\frac{1}{2}$△H1+3△H2-$\frac{3}{2}$△H3)
故答案为:$\frac{1}{2}$△H1+3△H2-$\frac{3}{2}$△H3;
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融的碳酸盐.电池反应方程式为C3H8+5O2=3CO2+4H2O;正极发生还原反应,反应式为:O2+2CO2+4e-=2 CO32-;原电池中的阴离子向负极移动,放电时CO32-移向电池的负极,惰性电极电解1000mL1mol/L的AgNO3溶液,阳极电极反应为4OH-4e-=2H2O+O2↑,阴极电极反应为:4Ag++4e-=4Ag,电解池的总反应方程式为:4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3,
故答案为:O2+2CO2+4e-=2 CO32-;负极;4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3.
点评 本题综合考查反应热的计算、原电池、电解原理,侧重于考查学生综合运用盖斯定律计算、电化学知识的能力,题目难度中等,注意把握新型燃料电池以及电解原理,盖斯定律计算为高频考点.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.8mol | B. | 1.2mol | C. | 0.9mol | D. | 0.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水制得Cl2 | B. | 电解熔融MgCl2制得金属Mg | ||
| C. | 高温下CO还原赤铁矿可用于炼铁 | D. | 电解熔融AlCl3制得金属Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
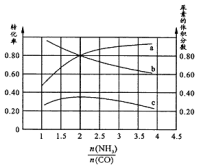 用CO合成尿素的反应为:2NH3(g)+CO(g)?CO(NH2)2(g)+H2(g)△H<0.
用CO合成尿素的反应为:2NH3(g)+CO(g)?CO(NH2)2(g)+H2(g)△H<0.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
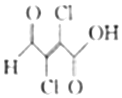 粘氯酸用于合成广谱高效新型杀螨剂哒螨酮、除草剂苯钠松,也用于医药磺胺吡啶和感光材料的合成,其结构简式如图所示.下列有关粘氯酸的说法不正确的是( )
粘氯酸用于合成广谱高效新型杀螨剂哒螨酮、除草剂苯钠松,也用于医药磺胺吡啶和感光材料的合成,其结构简式如图所示.下列有关粘氯酸的说法不正确的是( )| A. | 分子式为C4H2Cl2O3 | |
| B. | 能使酸性高锰酸钾溶液褪色 | |
| C. | 1mol粘氯酸与足量NaHCO3溶液反应,能产生标准状况下22.4LCO2 | |
| D. | 粘氯酸与足量H2反应生成M,则含一个甲基的M的同分异构体只有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 滴加少量硫酸铜溶液 | ||
| C. | 不用铁片,改用铁粉 | D. | 加少量浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 )有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是
)有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是 、
、 、
、 任意2种(写出任意2种的结构简式)
任意2种(写出任意2种的结构简式)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com