
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第________周期,第________族;PbO2的酸性比CO2的酸性________(填“强”或“弱”)。
(2)Pb O2与浓盐酸共热生成黄绿色气体,反应的化学方程式为________________。
O2与浓盐酸共热生成黄绿色气体,反应的化学方程式为________________。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为______________;PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解___,阴极上观察到的现象是________________;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为_______,这样做的主要缺点是________。
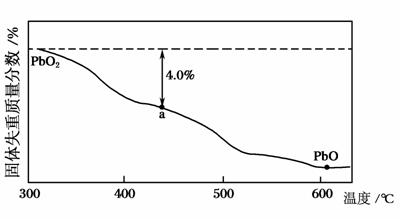
(4)PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%(即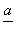 ×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和mn值________。
×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和mn值________。
解析 (1)碳在元素周期表中位于第二周期第ⅣA族,铅是碳的同族元素,比碳多4个电子层,故铅在元素周期表的位置为第六周期第ⅣA族;铅位于碳的下方,同主族元素由上到下,非金属性逐渐减弱,故PbO2的酸性比CO2的酸性弱。
(2)PbO2中的Pb为+4价,Pb为+2价时相对稳定,故PbO2中的Pb具有强氧化性,能发生类似MnO2与浓盐酸的反应,将Cl-氧化为Cl2,故反应方程式为PbO2+4HCl(浓)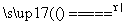 PbCl2+Cl2↑+2H2O。
PbCl2+Cl2↑+2H2O。
(3)由PbO和NaClO反应制PbO2,PbO→PbO2,Pb的化合价升高,则NaClO作氧化剂,本身被还原为NaCl,故离子方程式为PbO+ClO-===PbO2+Cl-;石墨为电极,电解Pb(NO3)2和Cu(NO3)2的混合液制PbO2,则Pb2+应在阳极发生氧化反应得到PbO2,故阳极电极反应式为Pb2++2H2O-2e-===PbO2+4H+;阴极上阳离子反应,阳离子有Pb2+、Cu2+、H+,根据阳离子放电顺序,应为Cu2++2e-===Cu,而生成的金属Cu会覆在石墨电极上,故阴极观察到的现象为石墨上包上铜镀层,若电解液中不加入Cu(NO3)2,阴极Pb2+放电,生成金属Pb,Pb2++2e-===Pb,这样Pb2+被消耗不能生成PbO2,降低了Pb2+的利用率。
(4)根据PbO2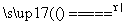
 PbOx+
PbOx+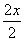 O2↑(注PbO2相对分子质量为239)
O2↑(注PbO2相对分子质量为239)
由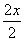 ×32=239×4.0%
×32=239×4.0%
得x=2- ≈1.4
≈1.4
根据mPbO2·nPbO
得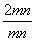 =1.4
=1.4  =
=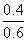 =
= 。
。
答案 (1)六 ⅣA 弱
(2)PbO2+4HCl(浓)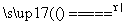 PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O
(3)PbO+ClO-===PbO2+Cl- Pb2++2H2O-2e-===PbO2+4H+ 石墨上包上铜镀层 Pb2++2e-===Pb 不能有效利用Pb2+
(4)根据PbO2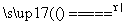 PbOx+(
PbOx+(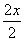 )O2↑,有
)O2↑,有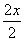 ×32=239×4.0%,x=2-(239×4.0%/16)=1.4,根据mPbO2·nPbO,
×32=239×4.0%,x=2-(239×4.0%/16)=1.4,根据mPbO2·nPbO,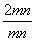 =1.4,m:n=
=1.4,m:n=


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
阿伏加德罗常数约为6.02×1023 mol-1,下列说法正确的是( )
A.2.3 g钠与足量丙三醇反应,转移电子数为0.3×6.02×1023
B.标准状况下,22.4 L乙醇的共价键数为8×6.02×1023
C.标准状况下,5.6 L甲醛所含的电子数为4×6.02×1023
D.100 mL 1 mol·L-1醋酸溶液中,H+的个数为0.1×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇。写出相应反应的化学方程式_______________________________________________________________。
(2)已知:甲醇脱水反应 2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH1=-23.9 kJ·mol-1
甲醇制烯烃反应 2CH3OH(g)===C2H4(g)+2H2O(g) ΔH2=-29.1 kJ·mol-1
乙醇异构化反应 C2H5OH(g)===CH3OCH3(g)
ΔH3=+50.7 kJ·mol-1
则乙烯气相直接水合反应C2H4(g)+H2O(g)===C2H5OH(g)的ΔH=________kJ·mol-1。与间接水合法相比,气相直接水合法的优点是__________________________。
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系[其中n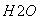 :n
:n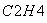 =1:1]
=1:1]
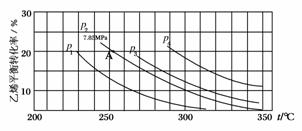
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②图中压强p1、p2、p3、p4的大小顺序为:________,理由是:______________________。
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃,压强6.9 MPa,n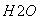 :n
:n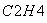 =0.6:1。乙烯的转化率为5%。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有:________________、________________。
=0.6:1。乙烯的转化率为5%。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有:________________、________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某混合溶液中含有等物质的量的CuSO4、FeSO4、Fe2(SO4)3。已知下表数据:
| 物质(25℃) | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
| 完全沉淀时的pH | ≥6.4 | ≥9.6 | 3~4 |
下列叙述正确的是( )
A.混合溶液中:c(SO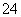 )[c(Cu2+)+c(Fe2+)+c(Fe3+)]=54
)[c(Cu2+)+c(Fe2+)+c(Fe3+)]=54
B.若向混合溶液中加入铁粉,不可能观察到红色固体析出
C.若向混合溶液中加入足量氯水,调节pH到3~4后过滤,得到纯净的CuSO4溶液
D.若向混合溶液中逐滴加入烧碱溶液,首先生成Fe(OH)3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象不能说明相关结论的是( )
A.将铜与浓硫酸共热,产生 使石蕊溶液变红的气体,说明浓硫酸具有酸性
使石蕊溶液变红的气体,说明浓硫酸具有酸性
B.将金属钠投入冷水中,钠熔为小球,说明钠与水的反应为放热反应且钠的熔点低
C.向AgCl浊液中滴加Na2S溶液,白色沉淀变成黑色,说明AgCl的溶解平衡正向移动
D.向Al(OH)3沉淀中滴加NaOH溶液或盐酸,沉淀均消失,说明Al(OH)3是两性氢氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值,下列有关NA的叙述中正确的是 ( )
A.惰性电极电解饱和食盐水,若电路中通过NA个电子,则阳极产生气体11.2L
B.标准状况下,4.0 g CH4中含有共价键的数目为NA
C.1 mol C12发生化学反应,转移的电子数必为2NA
D.在反应KIO3+6HI =KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
硫是一种很活泼的元素,在适宜的条件下能形成-2、+6、+4、+2、+1价的化合物。
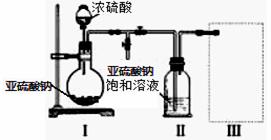 I:焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。带有强烈的SO2气味,水溶液生成NaHSO3呈酸性,久置空气中易氧化,故该产品不能久存。某研究小组采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。
I:焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。带有强烈的SO2气味,水溶液生成NaHSO3呈酸性,久置空气中易氧化,故该产品不能久存。某研究小组采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。
(1)装置I中的浓硫酸______ (能或不能)用稀硫酸代替,
原因是 。
(2)装置Ⅱ中有Na2S2O5晶体析出,要获得已析出的晶体,可采取的分离方法是_____________。
(3)装置Ⅲ用于处理尾气,请在虚线内画出尾气处理装置和药品。
(4)检验Na2S2O5晶体在空气中变质的实验方案是 。
II:而另一种硫的化合物Na2S2O3的溶液可以用于测定溶液中ClO2的含量,可进行以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-)
(1)准确量取10.00 mL ClO2溶液的玻璃仪器是 。
(2)确定滴定终点的现象为__________________________________。
(3)根据上述步骤计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)
(4)下列操作会导致测定结果偏高的是 。
A.未用标准浓度的Na2S2O3溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.滴定应在中性或弱酸性环境中进行,若溶液呈碱性
E.观察读数时,滴定前仰视,滴定后俯视
查看答案和解析>>
科目:高中化学 来源: 题型:
c(H+)相同的等体积的两份溶液A和B;A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出的氢气的质量相等,则下列说法正确的是( )
①反应所需要的时间B>A②开始反应时的速率A>B③参加反应的锌的物质的量A=B④反应过程的平均速率B>A⑤盐酸里有锌剩余⑥醋酸里有锌剩余
A ③④⑤ B ③④⑥ C ②③⑤ D ②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实对应的离子方程式或电极反应式书写正确的是( )
A.用石墨作电极电解CuSO4溶液:2Cu2++2H2O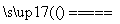 2Cu+O2↑+4H+
2Cu+O2↑+4H+
B.碳酸钠溶液显碱性:CO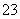 +2H2OH2CO3+2OH-
+2H2OH2CO3+2OH-
C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-===Fe3+
D.在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3===2FeO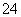 +3Cl-+H2O+4H+
+3Cl-+H2O+4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com