
【题目】一定温度下,向2.0L恒容密闭容器中充入1.0mol PCl5 , 反应PCl5(g)PCl3(g)+Cl2(g)△H,经过一段时间后达到平衡,反应过程中测定的部分数据如图.下列说法正确的是( ) 
A.反应在50s~250s内的平均速率v(PCl3)=4.0×10﹣4molL﹣1s﹣1
B.保持其他条件不变,升高温度,平衡时c(PCl5)=0.38 molL﹣1 , 则反应的△H<0
C.保持其他条件不变,将容器的容积缩小一半,平衡逆向移动,化学平衡常数减小
D.相同温度下,起始时向容器中充入0.5 mol PCl5 , 重新达到平衡时,0.1 mol<n(PCl3)<0.2 mol
【答案】D
【解析】解:A.由图中数据可知50s~250s内,△n(PCl3)=0.04mol,v(PCl3)= ![]() =1.0×10﹣4mol/(Ls),故A错误; B.由图中数据可知,平衡时n(PCl3)=0.2mol,则平衡时c(PCl5)=1mol﹣0.2mol=0.8mol,保持其他条件不变,升高温度,平衡时c(PCl5)=0.38 mol/L,则n′(PCl5)=0.76mol<0.8mol,说明升高温度平衡向正反应方向移动,升高温度平衡向吸热反应方向移动,故正反应为吸热反应,即△H>O,故B错误;
=1.0×10﹣4mol/(Ls),故A错误; B.由图中数据可知,平衡时n(PCl3)=0.2mol,则平衡时c(PCl5)=1mol﹣0.2mol=0.8mol,保持其他条件不变,升高温度,平衡时c(PCl5)=0.38 mol/L,则n′(PCl5)=0.76mol<0.8mol,说明升高温度平衡向正反应方向移动,升高温度平衡向吸热反应方向移动,故正反应为吸热反应,即△H>O,故B错误;
C.将容器的容积缩小一半,增大压强,平衡向气体体积减小的方向移动,即平衡向逆反应移动,但平衡常数只受温度影响,压强不影响平衡常数,故C错误;
D.D.与原平衡相比,压强减小,平衡向正反应方向移动,平衡时的PCl5转化率增大,则平衡时PCl3大于0.1mol,而再加入0.5mol PCl5后与原平衡为等效平衡,故0.5 molPCl5转化得到的PCl3小于0.2mol,故D正确,
故选:D.
【考点精析】根据题目的已知条件,利用化学平衡的计算的相关知识可以得到问题的答案,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
族 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)④、⑤、⑥的原子半径由大到小的顺序是 .
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 .
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: .
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号) . a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钠的说法中正确的是( )
A. 钠的含氧化合物都是碱性氧化物
B. 金属钠久置空气中最终转变为Na2O2
C. 钠可以将钛、铌等金属从其熔融的氯化物中置换出来
D. 过氧化钠只具有氧化性不具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚磷酸(H3PO3)是二元弱酸,且具有较强还原性.下列说法正确的是( )
A.Na2HPO3溶液显碱性,说明HPO32﹣的电离程度大于水解程度
B.25℃时,将0.1 mol?L﹣1的亚磷酸溶液加水稀释后,n(H+)与n(OH﹣)的乘积不变
C.利用H3PO3进行化学镀银,当参加反应的 ![]() =2时,氧化产物为H3PO4
=2时,氧化产物为H3PO4
D.NaH2PO3溶液显酸性,其溶液中存在的粒子浓度关系:c(H2PO3﹣)>c(HPO32﹣)>c(H3PO3)>c(H+)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到的密度为1.15g·cm-3的混合溶液。计算:
(1)混合后溶液的质量分数___________。
(2)混合后溶液的物质的量浓度_____________。
(3)在1000g水中需溶解_____________摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家在研究金属矿物质组分的过程中,发现了Cu﹣Ni﹣Fe等多种金属互化物.
(1)鉴别某种金属互化物是晶体还是非晶体的方法是 .
(2)已知高温下Cu2O比CuO更稳定,试从铜原子核外电子变化角度解释其原因 .
(3)镍能与类卤素(SCN)2反应生成Ni(SCN)2 . (SCN)2分子中硫原子的杂化方式是 , σ键和π键数目之比为;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N)的沸点低于异硫氰酸(H﹣N═C═S)的沸点,其原因是 .
(4)立方FeO晶体的结构如图1所示,设晶胞边长为a cm,密度为b gcm﹣3 , 则阿伏加德罗常数可表示为(用含a、b的式子表示).人工制备的FeO晶体常存在缺陷(如图2),已知某氧化物样品组成为Fe0.96O,该晶体中Fe3+与Fe2+的离子个数之比为 . 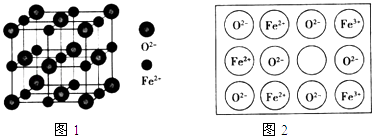
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料在日常生活以及生产中有着广泛的运用。下列关于金属的一些说法不正确的是( )
A. 合金的性质与其成分金属的性质不完全相同
B. 工业上金属Mg、Al都是用电解熔融的氯化物制得的
C. 金属冶炼的本质是金属阳离子得到电子变成金属原子
D. 越活泼的金属越难冶炼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四种化合物:①NaHCO3;②Al(OH)3;③Al2O3;④H2N—CH2—COOH中跟盐酸和氢氧化钠溶液都能反应的是( )
A.②④
B.①②
C.①②③
D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com