
 工艺流程如图.
工艺流程如图.分析 铍矿物(绿柱石-3BeO•Al2O3•6SiO2及少量FeO等)和方解石熔炼,然后加入稀硫酸,SiO2、Al2O3分别与CaCO3反应生成CaSiO3、铝酸钙,BeO和熔融方解石反应生成铍酸钙,FeO被氧化,然后加入稀硫酸溶解,浸出出液中含有BeSO4、Al2(SO4)3、Fe2(SO4)3,向滤液中加入硫酸铵,硫酸铝和硫酸铵反应生成NH4Al(SO4)2,通过离心沉淀得到NH4Al(SO4)2•12H2O,滤液中含有BeSO4、(NH4)2SO4、Fe2(SO4)3,然后向溶液中加入氨水,调节溶液pH除去铁离子,然后过滤得到氢氧化铁沉淀,滤液中含有BeSO4,再向溶液中加入氨水,得到Be(OH)2沉淀,煅烧氢氧化铍得到工业BeO,
(1)增大反应物接触面积,增大反应速率;
(2)“蒸发结晶离心除铝”若在中学实验室中进行,完整的操作过程蒸发浓缩、冷却结晶、洗涤、过滤;
(3)“中和除铁”过程中“中和”实质上是利用氨水和溶液中氢离子反应促进铁离子水解;
(4)高温条件下,碳酸钠和二氧化硅反应生成硅酸钠和二氧化碳;高温条件下,BeO和碳酸钠反应生成铍酸钠和二氧化碳,BeO转化为BeO22-后将消耗更多硫酸.
解答 解:铍矿物(绿柱石-3BeO•Al2O3•6SiO2及少量FeO等)和方解石熔炼,然后加入稀硫酸,SiO2、Al2O3分别与CaCO3反应生成CaSiO3、铝酸钙,BeO和熔融方解石反应生成铍酸钙,FeO被氧化,然后加入稀硫酸溶解,浸出出液中含有BeSO4、Al2(SO4)3、Fe2(SO4)3,向滤液中加入硫酸铵,硫酸铝和硫酸铵反应生成NH4Al(SO4)2,通过离心沉淀得到NH4Al(SO4)2•12H2O,滤液中含有BeSO4、(NH4)2SO4、Fe2(SO4)3,然后向溶液中加入氨水,调节溶液pH除去铁离子,然后过滤得到氢氧化铁沉淀,滤液中含有BeSO4,再向溶液中加入氨水,得到Be(OH)2沉淀,煅烧氢氧化铍得到工业BeO,
(1)增大反应物接触面积,增大反应速率,所以将熔炼物酸浸前通常要进行粉碎,其目的是提高铍元素的浸出速率和浸出率,故答案为:提高铍元素的浸出速率和浸出率;
(2)“蒸发结晶离心除铝”若在中学实验室中进行,完整的操作过程蒸发浓缩、冷却结晶、洗涤、过滤,
故答案为:蒸发浓缩、冷却结晶;
(3)“中和除铁”过程中“中和”实质上是利用氨水和溶液中氢离子反应,离子方程式为H++NH3•H2O=NH4++H2O;由于存在平衡Fe3++3H2O?Fe(OH)3+3H+,氨水中和H+,使c(H+)减小,上述平衡正向移动,使Fe3+转化为Fe(OH)3沉淀而除去,
故答案为:H++NH3•H2O=NH4++H2O;由于存在平衡Fe3++3H2O?Fe(OH)3+3H+,氨水中和H+,使c(H+)减小,上述平衡正向移动,使Fe3+转化为Fe(OH)3沉淀而除去;
(4)高温条件下,碳酸钠和二氧化硅反应生成硅酸钠和二氧化碳,反应方程式为SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑;高温条件下,BeO和碳酸钠反应生成铍酸钠和二氧化碳,反应方程式为BeO+Na2CO3$\frac{\underline{\;高温\;}}{\;}$ Na2BeO2+CO2↑,由BeO+2H+=Be2++H2O和BeO22-+4H+=Be2++2H2O可知,BeO转化为BeO22-后将消耗更多硫酸,
故答案为:SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑;BeO+Na2CO3$\frac{\underline{\;高温\;}}{\;}$ Na2BeO2+CO2↑;由BeO+2H+=Be2++H2O和BeO22-+4H+=Be2++2H2O可知,BeO转化为BeO22-后将消耗更多硫酸.
点评 本题考查物质分离和提纯,为高频考点,综合性较强,涉及离子方程式及化学方程式的书写、化学反应速率影响因素、分离提纯基本操作、盐类水解等知识点,明确反应原理及流程图中每一步发生的反应、采用的操作方法是解本题关键,题目难度中等.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | Al2O3难溶于水,不跟水反应,所以它不是Al(OH)3对应的氧化物 | |
| B. | 因为Al2O3是金属氧化物,所以它是碱性氧化物 | |
| C. | Al2O3属于两性氧化物 | |
| D. | Al2O3能与所有的酸、碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  除去CO中的CO2 | B. | 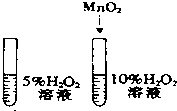 探究二氧化锰对反应速率的影响 | ||
| C. | 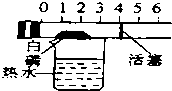 探究空气中氧气的含量 | D. |  探究溶解性的影响因素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是用浓硝酸、稀硝酸、铜片、水等试剂探究浓、稀硝酸的强氧化性并观察还原产物的实验装置.
如图是用浓硝酸、稀硝酸、铜片、水等试剂探究浓、稀硝酸的强氧化性并观察还原产物的实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Al3+、SO42-、NO3- | B. | Mg2+、K+、Cl-、NO3- | ||
| C. | HCO3-、K+、Cu2+、SO42- | D. | K+、Na+、OH-、Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na投入到水中:Na+H2O═Na++OH-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | Al2O3和NaOH溶液:Al2O3+2OH-═2AlO2-+H2O | |
| D. | FeCl2溶液跟Cl2反应:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com