
已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,现取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀平衡时,测得溶液的pH=13,则下列说法不正确的是:
A.所得溶液中由水离出的C(OH -)=1.0×10-13 mol·L-1
B.所加烧碱溶液的pH=13
C.所得溶液中C(Mg 2+)=5.6×10-10 mol·L-1
D.在整个反应过程中,H2O的电离度在逐渐减小
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
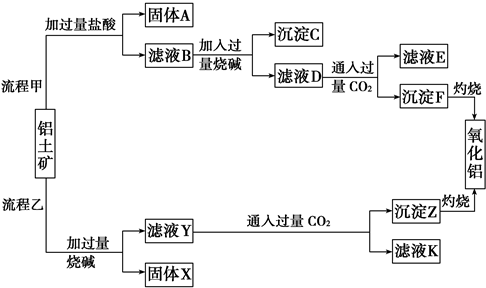
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| Cu2O |
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
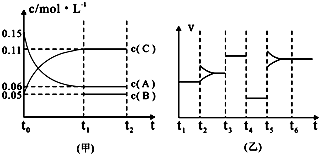
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省潍坊市高三2月月考化学试卷 题型:选择题
.已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,(MgF2的溶度积常数
Ksp=7.4×10-11)取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解
平衡,测得pH=13.0,则下列说法不正确的是( )
A.所得溶液中的c(H+)=1.0×10-13mol·L-1
B.所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol·L-1
C.所得溶液中的c(Mg2+)=5.6×10-10 mol·L-1
D.298K时,饱和Mg(OH)2的溶液与饱和MgF2溶液相比前者的c(Mg2+)大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com