

 TiO2•XH2O↓+4HCl
TiO2•XH2O↓+4HCl分析 (1)TiCl4在常温下是无色液体,应属于分子晶体;TiCl4水解生成TiO2•XH2O和HCl,依据原子个数守恒写出方程式;
(2)钛铁矿在高温下与焦炭经氯化得到四氯化钛,还生成氯化铁、CO;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(4)A.依据反应类型判断反应的热效应;
B.根据温度判断,在不同温度区域,TiI4的量是否发生改变;
C.温度不同,反应方程式不同,产物不同;
D.在提纯过程中,根据反应确定I2的量是否变化;
(5)①依据溶液中阳离子的移动方向判断电极;金属钛稳定性强于铁,抗氯气的腐蚀能力强于铁;
②氢氧化钠为强电解质,加入后能够增强电解质溶液的导电能力;
(6)依据转化关系:TiCl4~Ti,CO~CH3OH;
2TiCl4~6CO~6CH3OH~2Ti计算解答.
解答 解:(1)TiCl4在常温下是无色液体,应属于分子晶体,含有的化学键为极性共价键;TiCl4水解生成TiO2•XH2O和HCl,化学方程式:TiCl4+(x+2)H2O TiO2•XH2O↓+4HCl;
TiO2•XH2O↓+4HCl;
故答案为:极性共价键; TiCl4+(x+2)H2O TiO2•XH2O↓+4HCl;
TiO2•XH2O↓+4HCl;
(2)钛铁矿在高温下与焦炭经氯化得到四氯化钛,还生成氯化铁、CO,该反应为2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO,
故答案为:2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO;
(3)①Mg(s)+Cl2(g)=MgCl2(s)△H=-641KJ/mol
②Ti(s)+2Cl2(g)=TiCl4(g)△H=-770KJ/mol
由盖斯定律①×2-②,得到热化学方程式为:2Mg(s)+TiCl4(l)═2MgCl2(s)+Ti(s)△H=-512kJ/mol;
故答案为:2Mg(s)+TiCl4(l)═2MgCl2(s)+Ti(s)△H=-512kJ/mol;
(4)A.大多数混合反应是放热反应,该反应的正反应也是放热反应,则该反应正反应的△H<0,故A错误;
B.高于400℃,钛和氯气反应生成四氯化钛,在1250℃四氯化钛分解,所以在不同温度区域,TiI4的量不同,故B错误;
C.在提纯过程中,高于400℃,碘和钛反应生成四氯化钛,在1250℃四氯化钛分解生成碘和钛,所以I2的作用是将粗钛从低温区转移到高温区,故C正确;
D.在提纯过程中,高于400℃,碘和钛反应生成四氯化钛,在1250℃四氯化钛分解生成碘和钛,所以I2的量不变,可以循环利用故D正确;
故选:CD;
(5)①钠离子为阳离子,电解池中阳离子移向的极为阴极,所以右室为阴极,左室为阳极;
金属钛不易被腐蚀,生产的Cl2不会与之反应,抗腐蚀性强与铁,所以氯碱工业电解槽一般采用Ti网作阳极而不用Fe网;
故答案为:左室;金属钛不易被腐蚀,生产的Cl2不会与之反应;
②氢氧化钠为强电解质,加入后能够增强电解质溶液的导电能力;
故答案为:增强导电性;
(6)依据转化关系可知:
2TiCl4~6CO~6CH3OH~2Ti
6×32 2×48
112t m
解得m=56t
故答案为:56t,
点评 本题为综合题考查了电解池工作原理、热化学方程式的书写、有关方程式的计算,侧重对学生综合能力的考查,题目难度较大.


科目:高中化学 来源: 题型:解答题
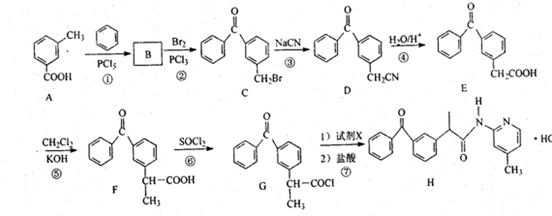
 +
+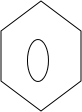 $\stackrel{PCl_{3}}{→}$
$\stackrel{PCl_{3}}{→}$ +H2O.
+H2O.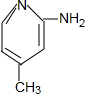 .
.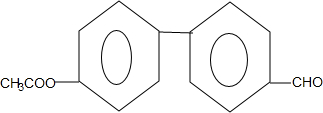 (只写一种).
(只写一种).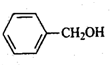 和
和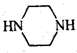 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
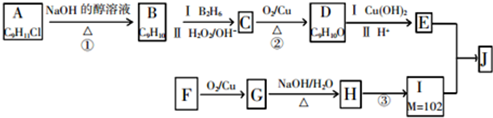
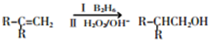
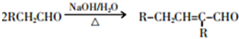
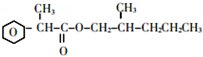 .
.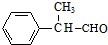 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$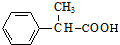 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.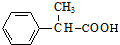 +CH3CH2CH2CH2CH(CH3)OH$→_{△}^{浓硫酸}$
+CH3CH2CH2CH2CH(CH3)OH$→_{△}^{浓硫酸}$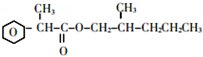 +H2O.F→G的化学方程式2CH3CH2CH2OH+O2$→_{△}^{Cu}$2CH3CH2CHO+2H2O.
+H2O.F→G的化学方程式2CH3CH2CH2OH+O2$→_{△}^{Cu}$2CH3CH2CHO+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O | |
| B. | 向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| C. | 氧化亚铁溶于稀硝酸:3FeO+8H++NO3-=3Fe3++NO↑+4H2O | |
| D. | 4 mol•L-1的NaAlO2溶液和7 mol•L-1的盐酸等体积混合:4AlO2-+7H++H2O=3Al(OH)3↓+Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向CuSO4溶液中滴加氨水,先生成深蓝色溶液,后生成蓝色沉淀 | |
| B. | 向NH4Fe(SO4)2溶液中滴加少量NaOH溶液,NH4+先发生反应 | |
| C. | 向等浓度的FeCl3和CuCl2混合溶液中加入少量Fe粉,Cu2+先被还原 | |
| D. | 足量锌与浓硫酸反应,先产生二氧化硫,后产生氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AD盐溶液pH>7 | B. | .酸的电离程度一定是HD<HC | ||
| C. | .碱的电离程度一定是AOH>BOH | D. | .在AC盐溶液中c(A+)+c(AOH)=c(C-)+c(HC) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 测量等浓度的Na2CO3与C6H5ONa溶液的pH | Na2CO3溶液的pH大于C6H5ONa的pH | H2CO3的酸性大于C6H5OH |
| B | 将SO2通入溴水中 | 溴水褪色 | SO2具有漂白性 |
| C | 取少量的变质FeCl2晶体于试管中,逐滴加入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | FeCl2未完全变质 |
| D | 向苯酚的苯溶液中加入足量NaOH溶液,振荡静置 | 分层 | 上层为苯,下层为NaOH与苯酚钠的混合溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com