
| n |
| V |
| ||
| V |
| ||
|
| 1000ρw% |
| M |
| ||
|
| n |
| V |
| ||
| V |
| ||
|
| 1000ρw% |
| M |
| 1000×1.19×44.9% |
| 36.5 |
| 5.60L |
| 22.4L/mol |
| 2 |
| 3 |
| 4.5g |
| 6.0g |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
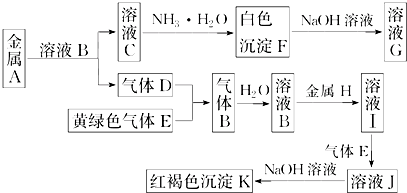
查看答案和解析>>
科目:高中化学 来源: 题型:
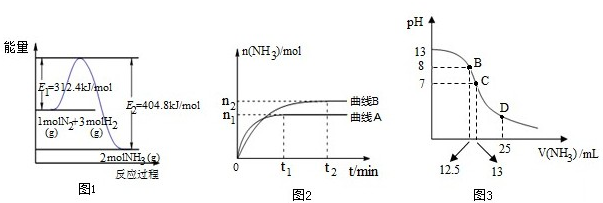
| n1 |
| 4t1 |
| 7 |
| 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
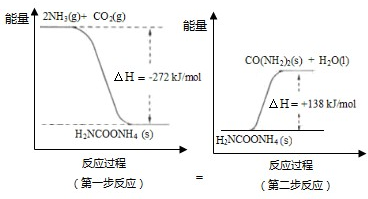
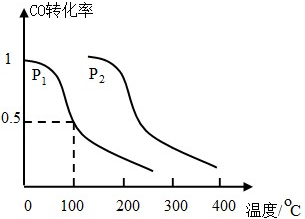
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸或碱 | 电离平衡常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3?H2O | 1.8×10-5 |
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 7×10-5 |
| CaCO3 | 5×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ABn | 分子的立体构型 | 典型例子 |
| n=2 | ||
| n=3 | ||
| n=4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时电子流入储氢合金电极 |
| B、放电时1molLaNi5H6失去6mol电子 |
| C、放电时正极反应为NiOOH+H2O-e-=Ni(OH)2+OH- |
| D、充电时外接电源的正极应该接在储氢合金的电极上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com