
 →CH≡C-CH═CH2
→CH≡C-CH═CH2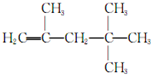 ,它是由不饱和烃乙的两个分子在一定条件下自身加成而得到的.在此反应中除生成甲外,同时还得到另一种产量更多的有机物丙,其最长的碳链仍为5个碳原子,丙是甲的同分异构体.则乙的结构简式是
,它是由不饱和烃乙的两个分子在一定条件下自身加成而得到的.在此反应中除生成甲外,同时还得到另一种产量更多的有机物丙,其最长的碳链仍为5个碳原子,丙是甲的同分异构体.则乙的结构简式是 ,丙的结构简式是
,丙的结构简式是 .
.
 .
. 分析 Ⅰ根据有机物甲的结构简式为 及反应原理
及反应原理 可以推断出有机物乙的结构简式;然后根据同分异构体的特点、反应原理及题干要求写出丙的结构简式;
可以推断出有机物乙的结构简式;然后根据同分异构体的特点、反应原理及题干要求写出丙的结构简式;
Ⅱ(1)选择含有碳碳双键最长的链为主链,从距离甲基近的一端编碳号,指明甲基、双键位置,据此进行命名;
(2)由B与C的结构简式可知,B分子中Cl原子被-COCH3取代;
(3)反应③是加成反应,由C、D的结构可知X的结构简式为CH≡CH;
(4)B的同分异构体很多,其不含甲基的链状同分异构体,应使碳碳双键、氯原子处于碳链的两端位置;
(5)E分子中含有醇羟基,具有醇的性质,含有碳碳双键,具有烯烃的性质,含有存在多个甲烷的四面体结构,所有碳原子不可能处于同一平面.
解答 解:Ⅰ由题目提供的信息及甲的结构简式 可知,有机物甲是由2分子不饱和烃乙发生信息中的加成反应得到的,故乙的结构简式为:
可知,有机物甲是由2分子不饱和烃乙发生信息中的加成反应得到的,故乙的结构简式为: ;
; 分子按如下方式:
分子按如下方式: 发生自身加成得到另一种产量更高的、最长碳链仍为5个碳原子的有机物丙:
发生自身加成得到另一种产量更高的、最长碳链仍为5个碳原子的有机物丙: ,
,
故答案为: ;
; ;
;
Ⅱ(1)有机物A的名称为:2-甲基-1,3-丁二烯,故答案为:2-甲基-1,3-丁二烯;
(2)由B与C的结构简式可知,B分子中Cl原子被-COCH3取代,属于取代反应,故答案为:取代反应;
(3)反应③是加成反应,由C、D的结构可知X的结构简式为CH≡CH,故答案为:CH≡CH;
(4)B的同分异构体很多,其不含甲基的链状同分异构体,应使碳碳双键、氯原子处于碳链的两端位置,该同分异构体的结构简式为: ,故答案为:
,故答案为: .
.
点评 本题考查有机物结构简式的判断、有机物命名、有机反应类型、有机物的结构与性质、同分异构体书写等,该题为中等难度的试题,试题综合性强,侧重对学生解题能力的培养和解题方法的指导与训练;该题的关键是根据已知的信息得出反应的原理,然后结合题意,灵活运用即可,试题有助于培养学生的创新思维能力和逆向思维能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族金属元素的原子半径越大,熔点越高 | |
| B. | 离子晶体固态或熔融状态下都能导电 | |
| C. | 原子最外层有3个电子的元素一定是主族元素 | |
| D. | 温度越高,金属晶体的导电性越好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的气化和石油的分馏均属物理变化 | |
| B. | 为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂 | |
| C. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| D. | 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳水化合物都符合通式Cn(H2O)m | |
| B. | 符合通式Cn(H2O)m的物质都是糖类 | |
| C. | 糖类物质都有甜味 | |
| D. | 糖类是人类维持生命的六大营养素之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硝酸钾溶于水 | |
| B. | 氨气和氯化氢反应生成氯化铵晶体 | |
| C. | 水蒸气凝结为液态的水 | |
| D. | (NH4)2CO3分解生成二氧化碳、氨气和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (一)石油分馏可以得到汽油.汽油是低沸点的烷烃的混合物,其分子中的碳原子数一般在C5~C12范围内,如戊烷,其分子式为C5H12,石油分馏属于物理变化(填“化学”或“物理”).
(一)石油分馏可以得到汽油.汽油是低沸点的烷烃的混合物,其分子中的碳原子数一般在C5~C12范围内,如戊烷,其分子式为C5H12,石油分馏属于物理变化(填“化学”或“物理”). .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合.
目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com