
已知:I2+2S2O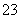 ===S4O
===S4O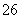 +2I-
+2I-
相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是______________________________(用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是____________________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用________作滴定指示剂,滴定终点的现象是______________________。
②CuCl2溶液与KI反应的离子方程式为__________________________。
③该试样中CuCl2·2H2O的质量百分数为________。
解析 (1)调节溶液pH时不应该带入其他杂质,故可选择Cu(OH)2、Cu2(OH)2CO3等物质消耗溶液中的H+,使溶液的pH升高;当溶液的pH=4时,c(H+)=1×10-4 mol·L-1,c(OH-)=1×10-10 mol·L-1,由Fe(OH)3的Ksp计算可得c(Fe3+)=Ksp/c3(OH-)=2.6×10-39/(1×10-30)=2.6×10-9(mol·L-1)。(2)由于加热能促进CuCl2的水解,且生成的HCl又易挥发而脱离体系,造成水解较完全,最终不能得到纯的无水CuCl2,反应方程式为2CuCl2·2H2O Cu(OH)2·CuCl2+2HCl+2H2O;要得到纯的无水CuCl2是让CuCl2·2H2O晶体在干燥的HCl气流中加热脱水。(3)滴定前的过程中发生反应:2Cu2++4I-===2CuI↓+I2,滴定过程中I2完全消失是滴定的终点,故可选用淀粉溶液作滴定指示剂,滴定终点的现象为蓝色褪去,且在半分钟内不恢复颜色;从反应2Cu2++4I-===2CuI↓+I2,I2+2S2O
Cu(OH)2·CuCl2+2HCl+2H2O;要得到纯的无水CuCl2是让CuCl2·2H2O晶体在干燥的HCl气流中加热脱水。(3)滴定前的过程中发生反应:2Cu2++4I-===2CuI↓+I2,滴定过程中I2完全消失是滴定的终点,故可选用淀粉溶液作滴定指示剂,滴定终点的现象为蓝色褪去,且在半分钟内不恢复颜色;从反应2Cu2++4I-===2CuI↓+I2,I2+2S2O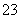 ===S4O
===S4O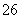 +2I-,可知Cu2+~S2O
+2I-,可知Cu2+~S2O ,n(Cu2+)=0.100 0 mol·L-1×20.00×10-3 L=2.0×10-3 mol,m(CuCl2·2H2O)=2.0×10-3 mol×171 g·mol-1=0.342 g,则试样中CuCl2·2H2O的质量百分数为0.342 g÷0.36 g×100%=95%。
,n(Cu2+)=0.100 0 mol·L-1×20.00×10-3 L=2.0×10-3 mol,m(CuCl2·2H2O)=2.0×10-3 mol×171 g·mol-1=0.342 g,则试样中CuCl2·2H2O的质量百分数为0.342 g÷0.36 g×100%=95%。
答案 (1)Cu(OH)2或Cu2(OH)2CO3
2.6×10-9 mol·L-1
(2)2CuCl2·2H2O Cu(OH)2·CuCl2+2HCl+2H2O 在干燥的HCl气流中加热脱水
Cu(OH)2·CuCl2+2HCl+2H2O 在干燥的HCl气流中加热脱水
(3)①淀粉溶液 蓝色褪去,放置一定时间后不复色
②2Cu2++4I-===2CuI↓+I2 ③95%


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
据报道,氢燃料电池公交车已经驶上北京街头。下列说法正确的是( )
A.电解水制取H2是理想而经济的制氢方法
B.发展氢燃料电池公交车不需要安全高效的储氢技术
C.氢燃料电池公交车的使用可以减少城市空气污染
D.氢燃料电池把H2和O2燃烧放出的热能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
主碳链为四个碳原子的某种烷烃有两种同分异构体,与它同碳原子数且主碳链也为四个碳原子的烯烃的同分异构体(不考虑顺反异构)数目为( )
A.2种 B.3种
C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,取浓度相同的NaOH和HCl溶液,以32体积比相混合,所得溶液的pH等于12,则原溶液的浓度为( )
A.0.01 mol·L-1 B.0.017 mol·L-1
C.0.05 mol·L-1 D.0.50 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,测得0.01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数为________________。
在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合。
(1)若所得混合液为中性,且a=2,b=12,则VaVb=________。
(2)若所得混合液的pH=10,且a=2,b=12,则VaVb=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:C(s)+CO2(g)2CO(g) ΔH>0。该反应达到平衡后,下列条件有利于反应向正反应方向进行的是( )
A.升高温度和减小压强
B.降低温度和减小压强
C.降低温度和增大压强
D.升高温度和增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,H2(g)+CO2(g)H2O(g)+CO(g)的平衡常数K=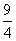 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)(mol·L-1) | 0.010 | 0.020 | 0.020 |
| c(CO2)(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O===O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为( )
A.920 kJ B.557 kJ
C.436 kJ D.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
锑(Sb)在自然界一般以硫化物的形式存在。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
2Sb2S3+3O2+6Fe===Sb4O6+6FeS ①
Sb4O6+6C===4Sb+6CO ②
关于反应①、反应②的说法正确的是 ( )。
A.反应①②中的氧化剂分别是Sb2S3、Sb4O6
B.反应①中每生成3 mol FeS时,共转移6 mol电子
C.反应②说明高温下Sb的还原性比C强
D.每生成1 mol Sb时,反应①与反应②中氧化剂的物质的量之比为1∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com