
| A. | 稀醋酸中加入少量醋酸钠固体能增大醋酸的电离程度 | |
| B. | 室温下,氨水加水稀释后,溶液中c(NH4+)•c(OH-)变大 | |
| C. | NaHCO3溶液中溶质的电离方程式为NaHCO3=Na++H++CO32- | |
| D. | 强电解质溶液导电能力不一定强于弱电解质溶液 |
分析 A.醋酸钠溶解醋酸根离子浓度增大抑制醋酸的电离;
B.加水稀释促进一水合氨电离,但铵根离子和氢氧根离子浓度都减小;
C.碳酸氢根离子是弱酸阴离子不能完全电离;
D.强电解质溶液导电能力不一定强于弱电解质,导电能力由离子浓度大小决定.
解答 解:A.稀醋酸中加入少量醋酸钠固体,溶解醋酸根离子浓度增大抑制醋酸的电离,能减少醋酸的电离程度,故A错误;
B.加水稀释促进一水合氨电离,但铵根离子和氢氧根离子浓度都减小,所以c(NH4+)•c(OH-)变小,故B错误;
C.NaHCO3溶液中溶质的电离方程式为:NaHCO3=Na++HCO3-,故C错误;
D.强电解质溶液导电能力不一定强于弱电解质,导电能力由离子浓度大小决定,如硫酸钡是强电解质水溶液中导电能力弱于弱电解质醋酸溶液的导电能力,故D正确;
故选D.
点评 本题考查了弱电解质电离平衡、影响因素分析判断、注意溶液导电能力和离子浓度有关,题目难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 使石蕊变红色溶液:Ca2+、K+、HCO3-、Cl- | |
| B. | 强碱性的无色溶液:Na+、Ba2+、OH-、Cl- | |
| C. | PH=7的无色溶液:NH4+、Mg2+、MnO4-、HCO3- | |
| D. | 加锌能产生氢气的溶液:H+、Cu2+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质水解反应:HCO3-+H2O?H3O++CO32- | |
| B. | 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | 微粒浓度关系:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) | |
| D. | 微粒浓度关系:c(Na+)=2[c(HCO3-)+c(CO32-)+c(H2CO3)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
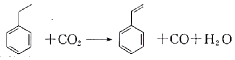
| A. | 分子中含有4个碳碳双键 | B. | 属于不含极性键的共价化合物 | ||
| C. | 分子式为C8H10 | D. | 通过加聚反应生成聚苯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 碳酸钠溶液可用于治疗胃病 | Na2CO3可与盐酸反应 | Ⅰ对,Ⅱ对,有 |
| B | 向Na2O2的水溶液中滴入酚酞变红色 | Na2O2与水反应生成氢氧化钠 | Ⅰ对,Ⅱ错,无 |
| C | 金属钠具有强还原性 | 高压钠灯发出透雾能力强的黄光 | Ⅰ对,Ⅱ对,有 |
| D | 过氧化钠可为航天员供氧 | Na2O2能与CO2和H2O反应生成O2 | Ⅰ对,Ⅱ对,有 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯水呈浅黄色,且有刺激性气味,说明有Cl2分子存在 | |
| B. | 加入有色布条后,有色布条褪色,说明有HClO分子存在 | |
| C. | 加入含有NaOH的酚酞试液,红色褪去,说明有H+离子存在 | |
| D. | 加入盐酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-离子存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④⑤ | C. | ①③⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a1>a2,c1>c2 | B. | a1<a2,c1<c2 | C. | a1>a2,c1<c2 | D. | a1<a2,c1>c2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com