

分析 (1)S8(s)和O2(g)发生反应转化为SO2(g)时放热为燃烧热,标注物质聚集状态和反应焓变写出热化学方程式;
(2)分析图象能量变化,写出化学方程式,标注物质聚集状态和反应焓变写出热化学方程式;
(3)依据反应热等于反应物的键能总和减去生成物键能总和计算分析.
解答 解:(1)S8(s)和O2(g)发生反应转化为SO2(g)时放热为燃烧热,由图可知生成1molSO2(g)放出热量为akJ,则燃烧热的S8(s)+8O2(g)═8SO2(g)△H=-8akJ•mol-1,故答案为:S8(s)+8O2(g)═8SO2(g)△H=-8akJ•mol-1;
(2)依据图象分析结合反应能量变化,写出化学方程式,标注物质聚集状态和反应热,SO3分解生成SO2和O2的热化学方程式为:SO3(g)=SO2(g)+$\frac{1}{2}$O2(g)△H=bKJ/mol,
故答案为:SO3(g)=SO2(g)+$\frac{1}{2}$O2(g)△H=+bKJ/mol;
(3)已知硫氧键(S=O)的键能为d kJ/mol,氧氧键(O=O)的键能为e kJ/mol,则S8分子中硫硫键(S-S)的键能;设S8分子中硫硫键键能为XKJ/mol;S8(s)+8O2(g)=8SO2(g)△H=-8aKJ/mol;依据反应热=反应物的键能总和-生成物的键能总和=8X+8e-16d=-8a,X=2d-a-e,
故答案为:(2d-a-e)KJ/mol.
点评 本题考查了反应能量变化的分析判断,焓变的计算应用,反应热和键能的计算关系应用,图象分析和概念理解是解题关键,题目难度中等.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Z结构中有4个手性碳原子 | |
| B. | Y的分子式为C9H8O3 | |
| C. | 1molZ余足量NaOH溶液反应,最多消耗8molNaOH | |
| D. | 1molZ与浓溴水反应最多消耗3molBr2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑦ | B. | ①⑧ | C. | ②⑧ | D. | ⑤⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: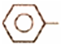 CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH=CH2(g)+H2(g)
CH=CH2(g)+H2(g)| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液加水稀释,$\frac{c(N{a}^{+})}{c(HC{{O}_{3}}^{-})}$的比值保持增大 | |
| B. | 在0.1 mol•L一1氨水中滴加0.lmol•L一1盐酸,恰好完全中和时溶液的pH<7 | |
| C. | 向0.lmol/L Na2S03溶液中加人少量NaOH固体,c(Na+)、c(SO32-)均增大 | |
| D. | 0.lmol•L一1氨水加水稀释,溶液中c(H+)和c(OH-)都减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 | |
| B. | 在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降 | |
| C. | 常温下pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等 | |
| D. | 0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列叙述正确的是( )
,下列叙述正确的是( )| A. | 有机物A属于芳香烃 | |
| B. | 有机物A和浓硫酸混合加热,可以发生消去反应 | |
| C. | 有机物A中含有两种官能团 | |
| D. | l mol A和足量的NaOH溶液反应,最多可以消耗3 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
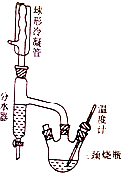 实验室制备正丁醚的原理如下:
实验室制备正丁醚的原理如下:| 物质 | 密度/g•mL-1 | 熔点/℃ | 沸点/℃ | 水溶性 |
| 正丁醇 | 0.81 | -89.8 | 117.7 | 微溶于水 |
| 正丁醚 | 0.769 | -98 | 142 | 不溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com