
【题目】在KOH和KAlO2混合溶液中滴加稀盐酸直到过量,生成沉淀与所加盐酸体积关系的图像正确的是

【答案】D
【解析】
试题分析:首先发生中和反应,没有沉淀产生,然后AlO2-+H++H2O=Al(OH)3↓,产生Al(OH)3沉淀,最后Al(OH)3 +3H+=Al3++3H2O,沉淀溶解,注意沉淀产生、沉淀溶解消耗的H+个数比是1:3。A、开始无沉淀生成,图象不符合,故A错误; B、依据分析可知,开始是中和反应,无沉淀生成,故B错误;C、开始无沉淀生成,随后生成沉淀达到最大后沉淀溶解,但沉淀产生、沉淀溶解消耗的H+个数比是1:3,离子定量关系不符合,故C错误;D、开始无沉淀生成,随后生成沉淀达到最大后沉淀溶解,沉淀产生、沉淀溶解消耗的H+个数比是1:3,离子定量关系符合,故D正确;故选D。


科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,c的最外层电子数为其内层电子数的3倍,b3-与C2-核外电子排布相同, d与c同族;e的最外层只有1个电子,次外层全充满。下列说法错误的是
A. a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为sp3
B. b、c、d中电负性最大的是d
C. e的价层电子排布图为![]()
D. 这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,该晶体结构中的作用力有离子键、极性键、配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组制备高铁酸钾(K2FeO4) 并探究其性质。
资料: K2FeO4 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4 (夹持装置略)

①A为氯气发生装置。A中化学反应的还原剂是_______。
②装置B的作用是除杂,所用试剂为___________。
③C中得到紫色固体和溶液。C中的反应有:3Cl2 + 2Fe(OH)3+ 10KOH=== 2K2FeO4 + 6KCl+ 8H2O
此反应表明:氧化性Cl2______FeO42-(填“>”或“<”)。
④C中除了发生③中的反应,还发生化学反应:__________。
(2)探究K2FeO4的性质
用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液a。取少量a,滴加盐酸,有Cl2产生。
①此实验可证明氧化Cl-的物质只能是FeO42-。用KOH溶液洗涤的目的是__________。
②此实验得出Cl2和FeO42-的氧化性强弱关系与制备实验时得出的结论相反,原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂和分离方法不正确的是( )
A | B | C | D | |
被提纯物质 | O2 (CO) | 乙酸乙酯(乙酸) | 酒精(水) | 溴苯(溴) |
除杂试剂 | 通过炽热的CuO | 饱和碳酸钠溶液 | 生石灰 | 氢氧化钠溶液 |
分离方法 | 洗气 | 分液 | 蒸馏 | 分液 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下焙烧CuFeS2的反应之一为2CuFeS2+7O2=CuSO4+CuO+Fe2O3+3SO2,下列关于该反应的叙述正确的是( )
A. CuFeS2中硫的化合价为-1
B. CuFeS2发生还原反应
C. 1 mol CuFeS2完全反应转移13 mol电子
D. CuSO4和SO2既是氧化产物,又是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对伞花烃(图I)常用作染料、医药、香料的中间体。下列说法错误的是
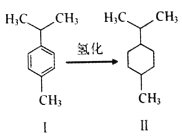
A. 常温对伞花烃呈液态且难溶于水
B. 图Ⅱ物质的一氯代物有5种结构
C. 对伞花烃最多有9个碳原子共平面
D. 图中氢化反应既是加成反应又是还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气遇氯气时,有白烟出现,发生的反应可能有①2NH3+3Cl2=6HCl+N2 ②NH3+HCl= NH4Cl下列说法正确的是()
A. ①为化合反应 B. ②为置换反应 C. ①氧化还原反应 D. ②为复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和生活中有重要的应用,下列说法正确的是( )
A. 苏打在生活中可用做发酵粉B. 磁性氧化铁可用于制备颜料和油漆
C. 石灰石既是制玻璃的原料又是制水泥的原料D. 二氧化硅可用于制作硅芯片
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com