
【题目】某实验过程如图所示:则图③的试管中的现象是
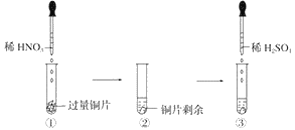
A. 无明显现象,因稀硫酸不与铜反应
B. 铜片溶解,产生无色气体,该气体遇到空气不变色
C. 铜片溶解,放出红棕色有刺激性气味的气体
D. 铜片溶解,产生无色气体,该气体在试管口变为红棕色
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+Q达到平衡,下列说法正确的是
2C(g)+Q达到平衡,下列说法正确的是
A. 加压,v(正)、v(逆)都增大,增大倍数v(正)小于v(逆)
B. 降温,v(正)、v(逆)都减小,减小倍数v(正)小于v(逆)
C. 使用催化剂,v(正)、v(逆)都改变,变化的倍数不同
D. 扩大容器体积,容器内A、B、C物质的量都减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是关于有机物A、B、C的信息:
A | B | C |
①它的产量可衡量一个国家石油化工发展水平; ②能使溴的四氯化碳溶液褪色; ③可用于果实催熟. | ①C、H两种元素组成 ②分子球棍模型为 | ①分子键线式为 ②相对分子质量为68 |
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称为_______________;
(2)A在一定条件下,与水反应制乙醇的化学方程式:____________________;反应类型是______。
(3)B具有的性质是_____________________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤任何条件下均不与氢气反应
⑥一定条件下,能与CH2=CH2反应制苯乙烷 ⑦与溴水混合后液体分层且上层呈橙红色
(4)写出B的最简单同系物制TNT的化学方程式 _____________________;反应类型是________。
(5)C是天然橡胶的单体,写出天然高分子橡胶的结构简式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
①SO2+2Fe3++2H2O===SO42-+2Fe 2++4H+;
②Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O。
下列有关说法不正确的是( )
A. SO2发生氧化反应
B. 若有13.44 L SO2(标准状况)参加反应,则最终消耗0.4mol K2Cr2O7
C. 氧化性:SO42- < Fe3+ < Cr2O72-
D. 每0.2 mol K2Cr2O7参加反应,转移电子的数目为1.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家哈伯因为氨气的合成曾获1918年诺贝尔奖。
(1)写出实验室制取氨气的化学方程式_______________。检验氨气已装满的方法是_______________。
(2)氨气可用如图装置进行喷泉实验,把氨气换成______(填序号)也可形成喷泉实验。
A.二氧化碳 B.氧气 C.氯化氢气体 D.氢气

(3)完成氨催化氧化生成为NO的反应方程式_________,产物NO有毒,不能排入空气中,若将NO和氧气一起通入水中能生成硝酸的化学方程式:________
(4)2.56gCu与足量的浓硝酸反应生成的气体与一定量的O2混合,然后通入水中恰好完全反应无气体剩余,则该氧气的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积,其氧化物是形成酸雨的重要原因 |
Z | Z和Y同周期,Z的电负性大于Y |
W | W的一种核素的质量数为63,中子数为34 |
(1)X能形成多种常见单质,在硬度最大的单质中,原子的杂化方式为_______。
(2)Z位于元素周期表的位置是___,Y的氢化物空间构型是_____。
(3)在H-Y、H-Z两种共价键中,键的极性较强的是______,X所在周期元素中氢化物最稳定的是______(用具体元素符号表示)。
(4)下列有关X2H4的说法正确的是_____。
A.分子中所有原子都满足8电子稳定结构
B.每个分子中σ键和π键数目之比为4:1
C.它是由极性键和非极性键构成的非极性分子
D.分子的空间构型为直线形
(5)向含有W2+的溶液中逐滴加入氨水至过量,期间出现的现象是________,写出最后所得配离子的结构式,要求标出配位键____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛是危害人类的无形杀手,是一种重要的工业原料。
(1)甲醛(H2C![]() O)在Ni的催化作用下加氢可得甲醇(CH3OH)。甲醛与甲醇相比,__________的沸点高,主要原因是__________
O)在Ni的催化作用下加氢可得甲醇(CH3OH)。甲醛与甲醇相比,__________的沸点高,主要原因是__________
(2)甲醛分子的空间构型为__________,其分子内的O—C — H键角__________(填“大于”“等于”或“小于”)甲醇分子内的O—C — H键角。
(3)甲醛分子是__________(填“极性分子”或“非极性分子”),它可由CO与H2在一定条件下反应合成。CO与N2的结构相似,一个CO分子内![]() 键的个数为__________,基态氧原子的价电子排布式是__________
键的个数为__________,基态氧原子的价电子排布式是__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com