考点:质量数与质子数、中子数之间的相互关系,原子结构示意图,物质的量的相关计算,元素周期律的作用,位置结构性质的相互关系应用,反应热和焓变
专题:基本概念与基本理论
分析:(1)①根据中子数=质量数-质子数,化合物的摩尔质量等于各原子的摩尔质量之和;Na原子和Cl原子之间通过得失电子形成离子键;
②O
2-核内有8个质子,核外有10个电子;氢化物中含有氢键的沸点较高;
(2)H、D、T三种原子,它们形成的单质为
H
2、
H
2、
H
2,
①在标准状况下,它们的单质密度之比等于摩尔质量之比;
②1mol各单质中,它们的质子数相同;
③1g各单质中,先求出单质的物质的量,再求质子数之比;先求出每个分子中的中子数,再计算;
④三种单质中电子数相同;
(3)①镓与Al同主族,为第ⅢA族元素;镓的最高价氧化物为Ga
2O
3,根据氧化铝与氢离子的反应写出其与氢离子的离子方程式;
②原子的电子层数越多,其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小,X只有-2价,则X为O元素,Y为-3、+5价,而且半径比O原子稍大,则Y为N,Z为+2、+4价,而且半径比N原子稍大,则Z为C元素,W、R均为+1价,而且半径W比O原子小,则W为H元素,R半径比O大很多,则为Na,结合元素周期律、原子结构来分析解答;
(4)①工业合成氨是利用氢气与氮气在高温高压催化剂条件下反应生成氨气;
②△H=反应物的总键能-生成物的总键能.
解答:
解:(1)①①
CI的中子数为37-17=20,该氯原子与
Na原子形成的化合物的摩尔质量为60g/mol;Na原子和Cl原子之间通过得失电子形成离子键,NaCl的形成过程为

;
故答案为:20;60g/mol;

;
②O
2-核内有8个质子,核外有10个电子,O
2-的结构示意图为

;氢化物中含有氢键的沸点较高,则沸点H
2O>H
2S,故答案为:

;>;
(2)H、D、T三种原子,它们形成的单质为
H
2、
H
2、
H
2,
①在标准状况下,它们的单质密度之比等于摩尔质量之比,则单质密度之比为1:2:3;故答案为:1:2:3;
②1mol各单质中,它们的质子数相同,它们的质子数之比为1:1:1;故答案为:1:1:1;
③1g各单质中,单质的物质的量分别为
mol、
mol、
mol,则质子数之比为为
:
:
=6:3:2;1g的D
2,T
2中的中子数之比为
×2:
×4=3:4;
故答案为:6:3:2;3:4;
④在同温、同压下,1L各种单质气体的物质的量相同,三种单质中电子数相同,则单质中所含电子数之比为1:1:1;
故答案为:1:1:1;
(3)①镓与Al同主族,为第ⅢA族元素;镓的最高价氧化物为Ga
2O
3,Ga
2O
3与氢离子的反应离子方程式为:Ga
2O
3+6H
+=2Ga
3++3H
2O;
故答案为:第ⅢA族;Ga
2O
3+6H
+=2Ga
3++3H
2O;
②原子的电子层数越多,其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小,X只有-2价,则X为O元素,Y为-3、+5价,而且半径比O原子稍大,则Y为N,Z为+2、+4价,而且半径比N原子稍大,则Z为C元素,W、R均为+1价,而且半径W比O原子小,则W为H元素,R半径比O大很多,则为Na,
ⅰ:同周期从左到右非金属性逐渐减弱,则X、Y、Z三种元素的非金属性的强弱顺序为O>N>C;故答案为:O>N>C;
ⅱ:W、X、Y按原子个数比为4:3:2组成一种离子化合物,化学式为 NH
4NO
3;故答案为:NH
4NO
3;
ⅲ:Na
2O
2是离子化合物,其电子式为
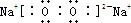
,CO
2是共价化合物,碳原子有四个电子分别和氧原子形成两对共用电子对,电子式为

,Na
2O
2与H
2O反应生成氢氧化钠和氧气,其反应的离子方程式为2Na
2O
2+2H
2O=4Na
++4OH
-+O
2↑,若反应中转移的电子数为0.4×6.02×10
23,即0.4mol电子,则参加反应的Na
2O
2的物质的量为0.4mol,其质量为31.2g;
故答案为:
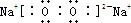
;

;2Na
2O
2+2H
2O=4Na
++4OH
-+O
2↑;31.2;
(4)①工业合成氨是利用氢气与氮气在高温高压催化剂条件下反应生成氨气,则反应的方程式为:N
2+3H
22NH
3;
故答案为:N
2+3H
22NH
3;
②在反应N
2+3H
2 
2NH
3中,1mol N
2完全反应为NH
3,断裂3mol H-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH
3,共形成6molN-H键,放出的能量为:6×390kJ=2340kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2340kJ-2254kJ=86kJ,
故答案为:放出;86.
点评:本题属于综合知识的考查,涉及的知识点较多,题目难度中等,侧重于对学生所学知识的综合应用能力的考查,注意对基础知识的积累.

 ;
; ;
; ;氢化物中含有氢键的沸点较高,则沸点H2O>H2S,故答案为:
;氢化物中含有氢键的沸点较高,则沸点H2O>H2S,故答案为: ;>;
;>;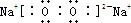 ,CO2是共价化合物,碳原子有四个电子分别和氧原子形成两对共用电子对,电子式为
,CO2是共价化合物,碳原子有四个电子分别和氧原子形成两对共用电子对,电子式为 ,Na2O2与H2O反应生成氢氧化钠和氧气,其反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,若反应中转移的电子数为0.4×6.02×1023,即0.4mol电子,则参加反应的Na2O2的物质的量为0.4mol,其质量为31.2g;
,Na2O2与H2O反应生成氢氧化钠和氧气,其反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,若反应中转移的电子数为0.4×6.02×1023,即0.4mol电子,则参加反应的Na2O2的物质的量为0.4mol,其质量为31.2g;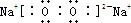 ;
; ;2Na2O2+2H2O=4Na++4OH-+O2↑;31.2;
;2Na2O2+2H2O=4Na++4OH-+O2↑;31.2; 2NH3中,1mol N2完全反应为NH3,断裂3mol H-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6molN-H键,放出的能量为:6×390kJ=2340kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2340kJ-2254kJ=86kJ,
2NH3中,1mol N2完全反应为NH3,断裂3mol H-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6molN-H键,放出的能量为:6×390kJ=2340kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2340kJ-2254kJ=86kJ,

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案