
【题目】(1)0.3molNH3分子中所含原子数与___________个H2O分子中所含原子数相等。
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有______________(填“氧化性”或“还原性”);
(3)现有一含有FeCl2 和FeCl3的混合样品,实验测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3 的物质的量分数为_________。
(4)某无色透明溶液中可能大量存在Ag+,Mg2+,Cu2+中的几种离子:
a. 取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,
取滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子是_________,
b. 原溶液中可能大量存在的阴离子是下列A-D中的(填序号)_________。
A.Cl- B.NO3- C.CO32- D.OH-
【答案】0.4NA 还原性 10% Ag+、Mg2+ B
【解析】
(1)根据n = ![]() 再结合分子构成分析计算;
再结合分子构成分析计算;
(2)防止食品被氧气氧化,则防腐剂具有还原性;
(3)根据元素守恒计算氯化亚铁和氯化铁物质的量之比,进而计算氯化铁质量分数;
(4)a. AgCl为不溶于稀硝酸的白色沉淀,加入过量NaOH溶液,出现白色沉淀,应为Mg(OH)2;
b. 根据上一问可知,溶液中存在的阳离子为Ag+和Mg2+,则结合离子共存的条件采用排除法作答。
(1)0.3mol NH3分子中含有的原子的物质的量为0.3 mol×4 = 1.2mol,则n(H2O) = ![]() = 0.4 mol,二者含有的原子个数相等,N(H2O) = 0.4mol × NA/mol = 0.4 NA个,
= 0.4 mol,二者含有的原子个数相等,N(H2O) = 0.4mol × NA/mol = 0.4 NA个,
故答案为:0.4 NA;
(2)防止食品被氧气氧化,则防腐剂具有还原性,
故答案为:还原性;
(3)设混合物中FeCl2物质的量为x,FeCl3的物质的量为y,则![]() = 12.1,得到x:y=9:1,氯化铁物质的量分数 =
= 12.1,得到x:y=9:1,氯化铁物质的量分数 = ![]() ×100% = 10%;
×100% = 10%;
故答案为:10%;
(4)a. 过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明原溶液中肯定有Ag+离子,反应的离子方程式为Ag++Cl═AgCl↓,在除去Ag+离子的溶液中,加入过量NaOH溶液,出现白色沉淀,则原溶液中一定存在Mg2+,
故答案为:Ag+、Mg2+;
b. 原溶液中存在的阳离子为Ag+和Mg2+,则Cl-与Ag+不共存,CO32-、OH-与溶液中的两种阳离子均不共存,故排除A、C、D选项,B项中NO3-与Ag+和Mg2+均不反应,可大量共存,故选B,
答案为:B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】图示表示物质X、Y、Z、W在一定条件下可以按照箭头一步转化。
序号 | X | Y | Z | W |
|
(1) | |||||
(2) |
|
| |||
(3) |
|
|
(1)X是金属单质,焰色反应呈黄色;Y的纯净物易潮解;Z可用于治疗胃酸过多;X在黄绿色的气体中燃烧可以产生白烟W(已知:电解熔融态的W可以得到X)。
X是:___________Y是:___________Z是:__________W是:__________(填写化学式)
(2)Z具有漂白性,但是不稳定,易分解产生含氯化合物。Z是:________(填写化学式)
(3)鉴别X、Y可以滴加___________溶液,前者出现血红色。(填写名称)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素及其化合物的转化关系如下图所示:

回答下列问题:
(1)实验室常用下图装置制取并收集氨气,试管中发生反应的化学方程式是_____________。
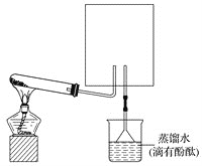
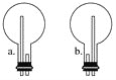
(2)上图中的方框内收集氨气的装置是________(填下图中的字母)。
(3)用NH3制取NO的化学方程式是__________________。
(4)工业上将NO2通入Na2CO3溶液中进行吸收处理,完成相应的化学方程式:2NO2+Na2CO3===NaNO2+________+________,_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)调查表明,嘉陵江大桥锈蚀速度每年为0.16mm,远远超过瑞典斯德尔哥尔摩大桥每年0.03mm的锈蚀速率。1982年6月8日,重庆市下了一场大雨,市郊1300多公顷水稻突然枯黄,好像火烧过一样,几天后,局部枯死。上述材料中出现的现象,产生的直接原因是_________________污染问题,在我国,形成该污染的气体主要是_________________。
(2)汽车尾气(含有烃类、CO、SO2与NO等物质)是城市的污染源。治理的方法之一是在汽车的排气管上装一个“催化转化器”(用铂、钯合金作催化剂)。它的特点是使CO和NO反应生成CO2和N2。请回答:
① CO与NO反应的化学方程式为_____________________________。
② 控制城市空气污染源的方法可以有_________________(填字母)
a.开发新能源 b.使用电动车 c.植树造林 d.带呼吸面具
(3)垃圾是放错了位置的资源,必须对垃圾进行分类回收。某住宅小区清理出以下垃圾:a.废纸 b.剩菜剩饭、瓜果皮 c.废旧电池 d.废玻璃瓶 e.废橡胶手套 f.一次性塑料饭盒。请用相应的字母填空。
① 其中可投入有![]() 标志垃圾箱的是_________________;
标志垃圾箱的是_________________;
② 其中适宜堆肥处理的垃圾是_________________;
③ 将垃圾按组成材料分类,其中属于硅酸盐材料的是____________;
④随意丢弃_________________,会造成白色污染。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用下列装置制FeCl3,可供选择的试剂有:①MnO2 ②NaOH溶液 ③饱和NaCl溶液 ④浓硫酸 ⑤浓盐酸。

(1)按气体流向由左到右排列,各装置的连接顺序为(填写A~E序号):__接__接___接__接__。
(2)装置连接好后,应该首先进行的实验操作是____________________________________________。
(3)A装置烧瓶中反应的离子方程式是_________________________________________。
(4)E中盛装的试剂是________,其作用是_________________________________________。
(5)停止反应后,还有铁丝剩余。为检验FeCl3的生成,并最终得到FeCl3溶液,甲同学设计以下实验步骤:
a.待B装置玻璃管冷却后,将管中物质用水溶解,________(填操作方法)除去不溶物;
b.取少量滤液,滴加________溶液,溶液呈现红色,以此检验Fe3+;
c.取少量滤液,滴加硝酸酸化的AgNO3溶液,检验Cl-。
(6)乙同学认为甲的实验设计不能最终得到FeCl3溶液,其理由是(写出相应的离子反应方程式)__________________________________________________________________。
你认为还选择下列哪些试剂才能制得较为纯净的FeCl3溶液________。
A.KMnO4(H+) B.Fe C.H2O2 D.Cl2 E.盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,几种难溶电解质的溶度积(Ksp):
化学式 | Mg(OH)2 | MgF2 | Fe(OH)3 | AgCl | Cu(OH)2 | Ag2CrO4 |
溶度积 | 5.6×10-12 | 7.4×10-11 | 4 .0×10-38 | 1.8×10-10 | 2.2×10-20 | 2.0×10-12 |
下列说法不正确的是( )
A. 在Mg(OH)2 的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B. 在Mg(OH)2 的悬浊液中加入NaF 溶液液后,Mg(OH)2 不可能转化为MgF2
C. CuCl2溶液中混入了一定量的FeCl3溶液,可以通过向溶液中加入CuO的方法,调整溶液的pH,除去Fe3+杂质
D. 向浓度均为1×10-3mol/L 的KCl 和K2CrO4混合液中滴加1×10-3mo/LAgNO3溶液,Cl-先形成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体 (H2C2O4)和浓硫酸混合缓慢加热时,可发生如下反应:H2C2O4 = CO2↑+CO↑+H2O 某课外活动小组的学生设计了如下实验装置,用来制取干燥纯净的 CO 气体,并用生成的 CO 气体还原 FexOy 制取铁粉。

(1)装置 B 的作用是_____。装置 E 中的现象是_________。装置 F 的作用是_________。
(2)装置 D 中玻璃管中发生反应的化学方程式为_____。
(3)若 FexOy 为 0.4g,生成的气体与过量澄清石灰水反应生成 0.75g 白色沉淀,则 FexOy 的化学式为_____。
(4)在实验开始时,点燃A、D 酒精灯的先后顺序是_____,实验完毕后,熄灭A、 D酒精灯的先后顺序是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备直径为1---100 nm的颗粒Y(化合物),反应原理为:![]() a
a![]() 下列说法中不正确的是
下列说法中不正确的是
A.a=4 B.将Y均匀分散到水中形成的体系具有丁达尔效应
C. ![]() 是还原剂 D. 每有3 mol
是还原剂 D. 每有3 mol ![]() 参加反应,反应中转移的电子总数为5 mol
参加反应,反应中转移的电子总数为5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在仪器①漏斗、②容量瓶、③蒸馏烧瓶、④分液漏斗、⑤烧杯、⑥蒸发皿 中,可用于粗盐提纯实验的有_____________________;可用于分离两种沸点接近且互不相溶的液态混合物实验的有_______________________。
(2)有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3、K2SO4中的一种或几种,现按下列步骤进行实验。
①将该粉末溶于水得无色溶液和白色沉淀。
②在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体。
③取滤液做焰色反应,可证明滤液中含Na+,不含K+。
由上述现象推断:
该混合物中一定含有_______________;一定不含有___________________,可能含有__________________。
(3)正常人的血液中葡萄糖(简称血糖,分子式为C6H12O6)的浓度在3.61-6.11mmol/L之间,今测得某病人1mL血液中含葡萄糖0.60mg,相当于____mmol/L,血糖属正常、偏高还是偏低?________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com