
分析 由Na+、Fe3+、Al3+、Ba2+、Ag+、OH-、Cl-、NO3-、CO32-、SO42-形成的化合物A、B、C、D、E均易溶于水,根据离子共存可知其中Ag+只有和NO3-共存,CO32-只能和Na+大量共存,OH-只能与余下的Ba2+大量共存,所以这些物质是硝酸银、碳酸钠、氢氧化钡,其中碳酸钠、氢氧化钡显碱性,
①将A与D混合有沉淀生成,此沉淀能溶于氨水,据题中离子可推知沉淀是氢氧化银,氢氧化银溶于氨水,形成配位化合物,从上面分析可知显碱性的物质有碳酸钠、氢氧化钡,所以D是氢氧化钡,A是硝酸银,E是碳酸钠;
②将D逐滴加入到C中直至过量,沉淀质量先增多后减少,说明C中有铝离子,氢氧化铝才会溶于氢氧化钡,但沉淀没溶解完全,所以C应是硫酸铝,硫酸铝与氢氧化钡反应可产生硫酸钡沉淀;
③将B与E混合有红褐色沉淀生成,同时又有无色无味的气体产生,这是三价铁离子与碳酸根发生双水解的原因,B只能是三氯化铁.
解答 解:依据分析可知:A为硝酸银,B为三氯化铁,C为硫酸铝,D为氢氧化钡,E为碳酸钠,
(1)A为硝酸银,B为三氯化铁,C为硫酸铝,D为氢氧化钡,E为碳酸钠,
故答案为:AgNO3;FeCl3;Al2(SO4)3;Ba(OH)2;Na2CO3;
(2)碳酸根水解生成碳酸氢根和氢氧根,故使得溶液显碱性,CO32-+H2O?HCO3-+OH-,
故答案为:CO32-+H2O?HCO3-+OH-;
(3)三价铁离子与碳酸根发生双水解生成红褐色沉淀氢氧化铁,同时又有无色无味的气体二氧化碳产生,
离子方程式为:2Fe3++3CO32-+3H2O═2Fe(OH)3↓+3CO2↑,
故答案为:2Fe3++3CO32-+3H2O═2Fe(OH)3↓+3CO2↑;
(4)三氯化铁可以净水,是因为三价铁离子发生水解生成氢氧化铁胶体,胶体表面积大,具有强的吸附性,从而达到净水的目的,
故答案为:三价铁离子发生水解生成氢氧化铁胶体,胶体表面积大,具有强的吸附性.
点评 本题综合性较强,考查了中学一些重要物质的性质,离子共存的灵活运用,特别是水解知识在生活中的应用,是高考的热点,注意积累.


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:解答题
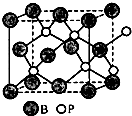 X、Y、Z、W、A五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,A原子的最外层电子数是最内层电子数的一半,其d轨道处于全充满状态.
X、Y、Z、W、A五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,A原子的最外层电子数是最内层电子数的一半,其d轨道处于全充满状态.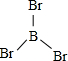 .
.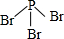 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
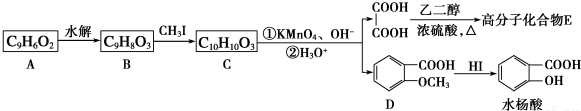
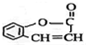 .
.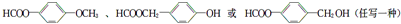 .
.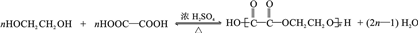 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+<Mg2+<Al3+<O2- | B. | S2->Cl->Na+>Al3+ | ||
| C. | Na<Mg<Al<S | D. | Cs<Rb<K<Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,33.6L氟化氢中含有氟原子数目为1.5NA个 | |
| B. | 1 molNa2O2与足量CO2反应,转移的电子数为2NA个 | |
| C. | 1L,1mol/L CH3COOH溶液中,所含CH3COO-、CH3COOH的总数为NA个 | |
| D. | 6.0g SiO2晶体中含有0.1NA个SiO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 向NaOH溶液中滴入少量Ca(HCO3)2溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | Na2CO3溶液中通入CO2:CO32-+CO2+H2O═2HCO3- | |
| D. | CH3COOH溶液与NaOH溶液反应:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X:澄清石灰水,Y:二氧化硫 | B. | X:漂白粉溶液,Y:二氧化硫 | ||
| C. | X:氢氧化钡溶液,Y:二氧化碳 | D. | X:偏铝酸钠溶液,Y:二氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取碳酸钠晶体66g | |
| B. | 定容时,俯视观察刻度线 | |
| C. | 移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗 | |
| D. | 定容后,将容量瓶振荡均匀,静置时发现液面低于刻度线,于是又加入少量水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com