

科目:高中化学 来源:不详 题型:单选题
A.溴水中有下列平衡   ,当加入 ,当加入 溶液后,溶液颜色变浅 溶液后,溶液颜色变浅 |
B.对   平衡体系,增大平衡体系的压强可使颜色变深 平衡体系,增大平衡体系的压强可使颜色变深 |
C.反应   (正反应放热),升高温度可使平衡向逆反应方向移动 (正反应放热),升高温度可使平衡向逆反应方向移动 |
| D.打开啤酒瓶盖后产生大量的气泡 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2 NH3 (g) ΔH<0,达平衡后,将气体混合物的温度降低,下列叙述中正确的是
2 NH3 (g) ΔH<0,达平衡后,将气体混合物的温度降低,下列叙述中正确的是| A.正反应速率增大,逆反应速率减小,平衡一定向正反应方向移动 |
| B.正反应速率减小,逆反应速率减小,平衡一定向逆反应方向移动 |
| C.若同时扩大容器的体积,则正逆反应速率一定都减小,平衡向逆反应方向移动 |
| D.若温度降低至氨气液化,则平衡一定向正反应方向移动,氨气产率提高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3,是工业上制造氮肥的重要反应。下列关于该反应的说法正确的是( )
2NH3,是工业上制造氮肥的重要反应。下列关于该反应的说法正确的是( )| A.增加N2的浓度能加快反应速率 |
| B.降低体系温度能加快反应速率 |
| C.使用催化剂不影响反应速率 |
| D.若反应在密闭容器中进行,N2和H2能100%转化为NH3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 第一份 | 加入0.5g水 | 很快产生火花 |
| 第二份 | 加入1胆矾 | 约需30s产生火花 |
| 第三份 | 加入1g无水硫酸铜 | 1min时仍没有明显反应现象 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.活化分子相互碰撞即可发生化学反应 |
| B.升高温度会加快化学反应速率,其原因是增加了活化分子的百分率 |
| C.某一反应的活化分子百分率是个定值 |
| D.浓度增大使得反应物分子中的活化分子百分率增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.还原剂 | B.氧化剂 | C.催化剂 | D.反应物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
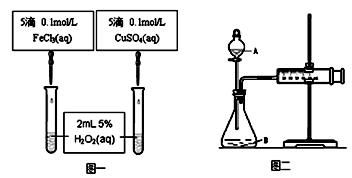
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com