
| ||
| ||
| 催化剂 |
| 加热 |
| ||
| ||
| 催化剂 |
| 加热 |
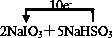 ,故答案为:
,故答案为: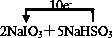 ;
;

科目:高中化学 来源: 题型:
| A、Ba(OH)2与NaHSO4 |
| B、Ba(OH)2与H2SO4 |
| C、HCl与Na2CO3 |
| D、Ca(HCO3)2与NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下HNO2溶液的pH小于7 |
| B、用HNO2溶液做导电实验,灯泡很暗 |
| C、HNO2和NaCl溶液不能发生反应 |
| D、用1L0.1 mol/L HNO2溶液和2L0.1mol/LNaOH溶液做导电实验,后者灯泡更亮 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)T℃时,向1L密闭容器中投入1mol CH4和1mol H2O(g),平衡时c(CH4)=0.5mol?L-1.该温度下反应CH4(g)+H2O(g)?CO(g)+3H2(g)的平衡常数K=
(1)T℃时,向1L密闭容器中投入1mol CH4和1mol H2O(g),平衡时c(CH4)=0.5mol?L-1.该温度下反应CH4(g)+H2O(g)?CO(g)+3H2(g)的平衡常数K=查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
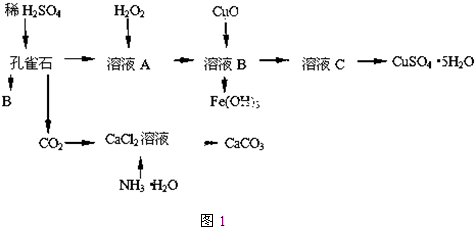
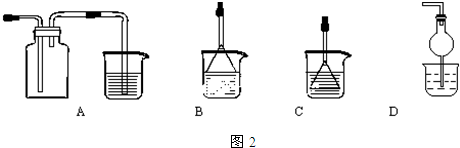
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2、SO3都是极性分子 |
| B、KF是离子化合物,HF为共价化合物 |
| C、在NH4+和[Cu(NH3)4]2+中都存在配位键 |
| D、PCl3和NF3分子中所有原子的最外层都达到8电子稳定结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com