
 ������Ϊһ���ִ���ͨ�������ڽ���ǧ��������β���к���CO��NOx���ж����壬����Ⱦ����Ҳ��Ϊ������ἱ���������⣮
������Ϊһ���ִ���ͨ�������ڽ���ǧ��������β���к���CO��NOx���ж����壬����Ⱦ����Ҳ��Ϊ������ἱ���������⣮| �¶ȣ��棩 | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
���� ��1����Ӧ�ȡ�H=�ϼ����յ�������-�ɼ��ų�����������ע�����ʵľۼ�״̬�뷴Ӧ����д�Ȼ�ѧ����ʽ��
��2����ƽ�ⳣ����ָ������Ũ�Ȼ�ѧ�������ݳ˻��뷴Ӧ��Ũ�Ȼ�ѧ�������ݳɼ�֮�ȣ�
��A������ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���
B����CH3OH��g������ϵ�з��룬ƽ�������ƶ���
C������He�����º����£������������Ũ�Ȳ��䣬ƽ�ⲻ�ƶ��ģ�
D���ٳ���1molCO��3molH2��ЧΪ��ԭƽ�������ѹǿ����һ����ƽ�������ƶ���
�ۼ���Ũ����Qc����Qc=K������ƽ��״̬����Qc��K����Ӧ���淴Ӧ���У���Qc��K����Ӧ������Ӧ���У�
��3�������Ǽ״�ȼ�����ɶ�����̼��ˮ��ԭ��ظ�������������Ӧ������������ԭ��Ӧ��������������õ������������ӣ����״��ڸ���ʧȥ���ӣ���O2-���ӽ�����ɶ�����̼��ˮ��
ԭ��ع���ʱ��������������������ƶ������������ƶ���
��� �⣺��1����Ӧ�ȡ�H=��945+498��kJ/mol-2��630kJ/mol=+183kJ/mol�����Ȼ�ѧ��Ӧ����ʽΪ��N2��g��+O2��g��=2NO��g����H=+183 kJ/moL��
�ʴ�Ϊ��N2��g��+O2��g��=2NO��g����H=+183 kJ/moL��
��2����CO��g��+2H2��g��?CH3OH��g����ƽ�ⳣ������ʽK=$\frac{c��C{H}_{3}OH��}{c��CO����{c}^{2}��{H}_{2}��}$��
�ʴ�Ϊ��$\frac{c��C{H}_{3}OH��}{c��CO����{c}^{2}��{H}_{2}��}$��
��A������ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ����״����ʼ�С����A����
B����CH3OH��g������ϵ�з��룬ƽ�������ƶ����״���������B��ȷ��
C������He�����º����£������������Ũ�Ȳ��䣬ƽ�ⲻ�ƶ����״����ʲ��䣬��C����
D���ٳ���1molCO��3molH2��ЧΪ��ԭƽ�������ѹǿ����һ����ƽ�������ƶ����״���������D��ȷ��
�ʴ�Ϊ��BD��
��250���ø÷�Ӧ�ķ�Ӧ�����������Ũ��Ϊ��c��CO��=0.4mol•L-1��c��H2��=0.4mol•L-1��c��CH3OH��=0.8mol•L-1��Ũ����Q=$\frac{0.8}{0.4��0��{4}^{2}}$=12.5��K=2.041��˵����Ӧ������У���v����v����
�ʴ�Ϊ������
��3�������Ǽ״�ȼ�����ɶ�����̼��ˮ��ԭ��ظ�������������Ӧ������������ԭ��Ӧ��������������õ������������ӣ����״��ڸ���ʧȥ���ӣ���O2-���ӽ�����ɶ�����̼��ˮ�������缫��ӦʽΪ��CH3OH+3O2--6e-�TCO2+2H2O��
ԭ��ع���ʱ��������������������ƶ������������ƶ��������������O2-���ƶ���
�ʴ�Ϊ��CH3OH+3O2--6e-�TCO2+2H2O������
���� ���⿼�黯ѧƽ�������Ӱ�����ء��Ȼ�ѧ����ʽ��д�����ԭ���ȣ���4����ע����Ŀ��Ϣ���ã����������ܷ�Ӧʽ��ȥ������Ӧ�ĵõ�������Ӧʽ���Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
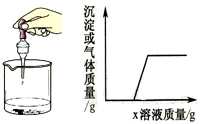 ���ձ�����μ���x��Һ����������Ӧ���������ɳ�������������������x��Һ��������ϵ������ͼ��ʾ�����߱�ʾ���ǣ�������
���ձ�����μ���x��Һ����������Ӧ���������ɳ�������������������x��Һ��������ϵ������ͼ��ʾ�����߱�ʾ���ǣ�������| ��� | �ձ��е����� | x��Һ |
| A | ��������� | ϡHCl |
| B | ������ϡ���� | BaCl2��Һ |
| C | þ���Ͻ� | NaOH��Һ |
| D | AlCl3��MgCl2��Һ | NaOH��Һ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������������Al+2H+�TAl3++H2�� | |
| B�� | ̼��þ���������У�2H++CO32-�TCO2��+H2O | |
| C�� | �ڳ����ʯ��ˮ��ͨ��������CO2��Ca2++2OH-+CO2�TCaCO3��+H2O | |
| D�� | �����Ȼ�����Һ�����ˮ�У�Fe3++3H2O$\frac{\underline{\;\;��\;\;}}{\;}$Fe��OH��3��+3H+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
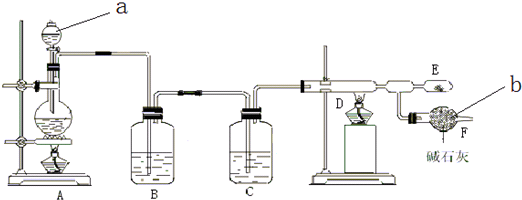
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ���� ��ʱ��/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| ������Ӧʽ | lgK�� | ||
| 700K | 900K | 1200K | |
| C��s��+H2O��g��=CO��g��+H2��g�� | -2.64 | -0.39 | 1.58 |
| C��s��+2H2O��g��=CO2��g��+2H2��g�� | -1.67 | -0.03 | 1.44 |


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������N2��CO������ͬ��Ŀ��ԭ�� | |
| B�� | 1mol������1.5mol����������ͬ����ԭ���� | |
| C�� | 1mol�����к���12.04��1023����ԭ�ӣ��ڳ��³�ѹ��ռ�����22.4L | |
| D�� | �����ʵ����ĸɱ��������ǣ�C6H12O6��������̼ԭ����֮��Ϊ1��6����ԭ����֮��Ϊ1��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| �� | �� | �� | �� | |
| ��Ӧǰ����/g | 64 | 10 | 1 | 25 |
| ��Ӧ������/g | 0 | 54 | 37 | 9 |
| A�� | 1��2 | B�� | 1��1 | C�� | 2��1 | D�� | 2��3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com