
在乙烯、乙醛(C2H4O)组成的混合物中,氢元素的质量分数是9%,则氧元素的质量分数为( )
A. 16% B. 37% C. 48% D. 无法计算
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源:2015-2016学年宁夏高二下学期期中考试化学试卷(解析版) 题型:选择题
下列化学用语正确的是 ( )
A.乙醇的结构简式:C2H6O
B.HF的电子式: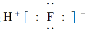
C.Mg2+的核外电子排布式:1s22s22p6
D.N2的结构简式:∶N≡N∶
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省冀州市高一下期末文科化学A卷(解析版) 题型:选择题
对于放热反应2H2+O2 2H2O,下列说法正确的是( )
2H2O,下列说法正确的是( )
A.产物H2O所具有的总能量高于反应物H 2和O2所具有的总能量
2和O2所具有的总能量
B.反应物H2和O2所具有的总能量高于产物H2O所具有的总能量
C.反应物H2和O2所具有 的总能量等于产物H2O
的总能量等于产物H2O 所具有的总能量
所具有的总能量
D.反应物H2和O2具有的能量相等
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省冀州市高一下期末理科化学A卷(解析版) 题型:选择题
诗句“春蚕到死丝方尽,蜡炬成灰泪始干”中丝和泪分别指( )
A.纤维素 油脂 B.蛋白质 烃类 C.淀粉 油脂 D.蛋白质 油脂
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省冀州市高一下期末理科化学A卷(解析版) 题型:选择题
将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。不能判断该分解反应已经达到化学平衡的是( )
2NH3(g)+CO2(g)。不能判断该分解反应已经达到化学平衡的是( )
A.密闭容器中二氧 化碳的体积分数不变
化碳的体积分数不变
B.密闭容器中气体的总物质的量不变
C.密闭容器中混合气体的密度不变
D.v(NH3)正=2 v(CO2)逆
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省冀州市高一下期末理科化学A卷(解析版) 题型:选择题
下列关于苯的叙述正确的是( )
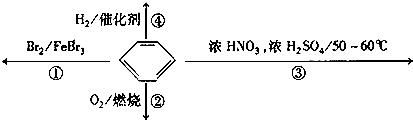
A. 反应①为取代反应,有机产物的密度比水小
B. 反应②为氧化反应,反应现象是火焰明亮并带有较多的黑烟
C. 反应③为取代反应,有机产物是一种烃
D. 反应④1mol苯最多与3molH2发生加成反应,是因为苯分子含有三个碳酸双键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省冀州市高一下期末理科化学A卷(解析版) 题型:选择题
下列实验不能达到预期目的的是( )
序号 | 实验操作 | 实验目的 |
A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
B | MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝的金属性强弱 |
C | 测定相同浓度H2CO3、H2SO4两溶液的pH | 比较碳、硫的非金属性强弱 |
D | Fe、Cu分别与盐酸反应 | 比较铁、铜的金属性强弱 |
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三下模拟考试理综化学试卷(解析版) 题型:实验题
氯化锶晶体在工业上常用作铝的缓蚀剂。工业上一般用难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体(SrCl2·6H2O)的过程为:
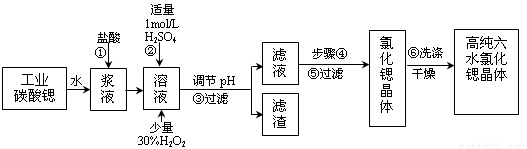
已知:Ⅰ.SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
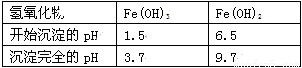
Ⅱ. 有关氢氧化物开始沉淀和完全沉淀的pH如下表:
(1)操作①在实际工业生产中常常把碳酸锶粉碎并加以搅拌,其目的是 。碳酸锶与盐酸反应的化学方程式为 。
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为__________。能否用新制氯水代替双氧水 (填“能”或“否”)。
(3)在步骤②-③的过程中,将溶液的pH值由1调节至 ;宜用的试剂为 。
A.1.5 B.4 C.9.7
D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体 G.氧化锶粉末
(4)操作③中所得滤渣的主要成分是 (填化学式)。
(5)工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是 。
(6)步骤⑥中,洗涤氯化锶晶体最好选用 。
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三毕业班最后一卷理综化学试卷(解析版) 题型:简答题
Cu2S 可用于制防污涂料,其可由热的铜在硫蒸气或H2S 中反应制得。
(1)铜元素在元素周期表中的位置为 ____________,Cu+的核外电子排布式为_________,基态铜原子核外电子共有__________种运动状态。
(2)Cu2S在一定条件下可被氧化为CuSO4。
①在SO42—中S原子的杂化轨道类型为________;SiO44—、PO43—与 SO42—互为________;其中Si、P、S第一电离能由大到小顺序为________________ ;
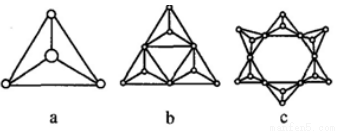
②硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元,硅氧四面体可以用图a 表示,图中b、c 是硅氧四面体结合成环状结构的两个例子,若在环状结构中硅的原子数为n,写出环状结构中硅酸根离子的通式_______________。
(3)甲醇(CH3OH)中的羟基被硫羟基取代生成甲硫醇(CH3SH),二者部分物理性质如下:
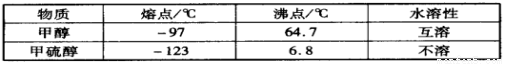
甲醇和甲硫醇在熔沸点和水溶性方面性质差异的原因是__________________________。
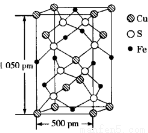
(4)某化合物由S、Fe、Cu 三种元素组成,其晶胞结构如下图所示(1 pm=10-10cm),该晶胞上下底面为正方形,侧面与底面垂直,则该晶体的密度ρ=_________g/cm3(保留三位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com