I������������ʵ�����������õ���Ⱥ͵���ƽ�ⳣ����ʾ���±�1�dz����¼�������ĵ���ƽ�ⳣ����K
a��������ĵ���ƽ�ⳣ����K
b����
��1
| ���� |
����ƽ�ⳣ����Ka�� Kb�� |
| CH3COOH |
1.8��10-5 |
| HNO2 |
4.6��10-4 |
| HCN |
5��10-10 |
| HClO |
3��10-8 |
| NH3?H2O |
1.8��10-5 |
��ش��������⣺
��1��������������������������
HCN
HCN
���û�ѧʽ��ʾ����������ʹ������Һ��CH
3COOH�ĵ���̶���������ƽ�ⳣ������IJ�����
B
B
������ţ���
A�������¶� B����ˮϡ�� C����������CH
3COONa���� D��������������
��2��CH
3COONH
4��ˮ��Һ��
����
����
��ѡ����ԡ������ԡ����ԡ����������ǣ�
CH3COOH��NH3?H2O�ĵ���ƽ�ⳣ����ȣ���֪CH3COO-��NH4+�����Ũ��ʱ��ˮ��̶���ͬ
CH3COOH��NH3?H2O�ĵ���ƽ�ⳣ����ȣ���֪CH3COO-��NH4+�����Ũ��ʱ��ˮ��̶���ͬ
����Һ�и�����Ũ�ȴ�С�Ĺ�ϵ��
c��NH4+��=c��Cl-����c��H+��=c��OH-��
c��NH4+��=c��Cl-����c��H+��=c��OH-��
��
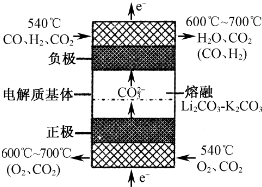
II�����ǵ����Ϻ�����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã���ش��������⣺��ͼ���漰����Ϊ��̬��
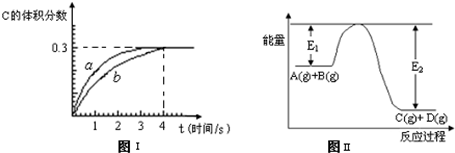
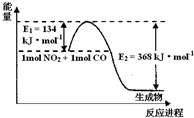
��1����ͼ��1mol NO
2��1mol CO��Ӧ����CO
2��NO�����������仯ʾ��ͼ����д��NO
2��CO��Ӧ���Ȼ�ѧ����ʽ
NO2��g��+CO��g��=CO2��g��+NO��g����H=-234kJ?mol-1
NO2��g��+CO��g��=CO2��g��+NO��g����H=-234kJ?mol-1
��
��2����0.5L���ܱ������У�һ�����ĵ����������������»�ѧ��Ӧ��N
2��g��+3H
2��g��?2NH
3��g����H��0���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���������������⣮
| t/�� |
200 |
300 |
400 |
| K |
K1 |
K2 |
0.5 |
���ԱȽ�K
1��K
2�Ĵ�С��K
1_
��
��
K
2�������������=����������
�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������
c
c
���������ĸ����
a��������N
2��H
2��NH
3��Ũ��֮��Ϊ1��3��2 b��v ��N
2��
��=3v ��H
2��
��c��������ѹǿ���ֲ��� d�����������ܶȱ��ֲ���
����400��ʱ�������NH
3��N
2��H
2�����ʵ����ֱ�Ϊ1mol��2mol��3molʱ����÷�Ӧ��v��N
2��
����
��
v��N
2��
���������������=����������



 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�
 I������������ʵ�����������õ���Ⱥ͵���ƽ�ⳣ����ʾ���±�1�dz����¼�������ĵ���ƽ�ⳣ����Ka��������ĵ���ƽ�ⳣ����Kb����
I������������ʵ�����������õ���Ⱥ͵���ƽ�ⳣ����ʾ���±�1�dz����¼�������ĵ���ƽ�ⳣ����Ka��������ĵ���ƽ�ⳣ����Kb����