
【题目】欲提纯混有硫酸钠、碳酸氢铵的氯化钠固体,某学生设计了如下方案:
(已知碳酸氢铵受热分解后无固体剩余)
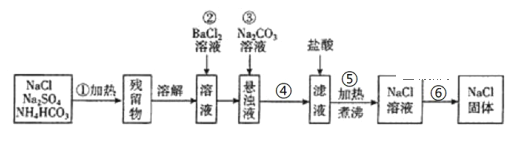
请根据操作流程回答下列问题:
(1)操作①在加热时应选择用_____________来盛装混合物(填仪器名称)。
(2)操作②发生的化学反应方程式为:___________________________________________;
判断SO42-已沉淀完全的方法是______________________________________________。
(3)操作③的目的是___________________________________。
(4)操作④和操作⑥的分离提纯方法的名称分别是____________、_____________。
【答案】坩埚(或硬质玻璃管)BaCl2+ Na2SO4 = BaSO4↓ + 2NaCl取上层清液少许于洁净试管中,滴加BaCl2溶液,若不变浑浊,则证明SO42-已沉淀完全除尽过量的BaCl2过滤蒸发结晶
【解析】
(1)操作①对固体进行加热,在加热时应选择用坩埚或硬质玻璃管来盛装混合物;
(2)加入硝酸钠溶液,硝酸钠和硫酸钠反应生成硫酸钡和硝酸钠,反应的化学方程式为BaCl2+ Na2SO4 = BaSO4↓ + 2NaCl;加入过量氯化钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴氯化钡溶液,不出现浑浊就说明硫酸根离子已经除尽,故答案为:取上层清液少许于洁净试管中,滴加BaCl2溶液,若不变浑浊,则证明SO42-已沉淀完全;
(3)操作③加入碳酸钠溶液,碳酸钠与过量的氯化钠反应生成碳酸钡和氯化钠,除去过量的氯化钡,再过滤;先过滤而后加碳酸钠溶液,在加入碳酸钠溶液后生成的碳酸钡还需要过滤,故答案为:除去过量的BaCl2;
(4)操作④将混浊液进行过滤;操作⑥为氯化钠溶液蒸发结晶得到氯化钠晶体;故答案为过滤、蒸发结晶。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C. 第二阶段,Ni(CO)4分解率较低
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种磁性材料的磨削废料(含镍质量分数约21%) 主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制各纯度较高的氢氧化镍,工艺流程如下:
回答下列问题:
(1)合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,反应有N2生成.写出金属镍溶解的离子方程式________________________________________。
(2)“除铁”时H2O2的作用是____________,为了证明添加的H2O2已足量,应选择的试剂是_____________(用化学式表示)溶液。黄钠铁矾[NaFe3(SO4)2(OH)6]具有沉淀颗粒大、沉淀速率快、容易过滤等特点,此步骤加入碳酸钠的目的是_________________________。
(3)“除铜”时,反应的离子方程式为_________________________,若用Na2S代替H2S除铜,优点是_________________________。
(4)已知除杂过程在陶瓷容器中进行,NaF的实际用量为理论用量的1.1倍,用量不宜过大的原因是_________________________。
(5)已知常温下Ksp[Ni(OH)2]=2.0×10-15,该流程中Ni(OH)2 生成时,调节pH 约为________Ni2+刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,认为该离子沉淀完全: lg2=0.30)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于苯的叙述正确的是
A.苯在常温下为液体,密度比水大
B.苯环是由单、双键交替形成的平面六元环结构
C.1 mol苯最多与3 mol H2发生加成反应
D.苯在FeBr3催化作用下能与Br2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于乙酸和乙醇的叙述正确的是
A.都能使石蕊溶液变红
B.分子中原子之间只存在单键
C.都能与钠反应并生成H2
D.都能与NaHCO3反应并生成CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,易挥发,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水;草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解(H2C2O4·2H2O ![]() 3H2O + CO↑ + CO2↑)。回答下列问题:
3H2O + CO↑ + CO2↑)。回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物,装置C中可观察到的现象是有无色气泡且澄清石灰石变浑浊,由此可知草酸晶体分解的产物中有CO2,装置B的主要作用是____________________________________________________________________________。
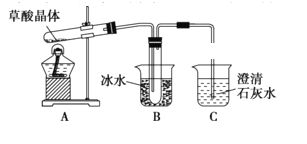
(2)乙组同学认为草酸晶体分解产物中还有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可重复选用)进行实验,装置H中装有的物质是CuO。

乙组同学的实验装置中,依次连接顺序为A、B、F、D、G、H、D、I。证明草酸晶体分解产物中有CO的现象是___________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关键能数据如表
化学键 | Si—O | O=O | Si—Si |
键能/kJ·mol-1 | x | 498.8 | 176 |
晶体硅在氧气中燃烧的热化学方程式:Si(s)+O2(g)=SiO2(s);ΔH=-989.2 kJ·mol-1,则表中x的值为 ( )
A.460B.920
C.1165.2D.423.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是人类最理想的能源。已知在25℃、101 kPa下,1 g 氢气完全燃烧生成液态水时放出热量142.9 kJ,则下列热化学方程式书写正确的是( )
A.2H2+O2=2H2O ΔH=-142.9 kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l)ΔH=-142.9 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ·mol-1
D.2H2(g)+O2(g)=2H2O(l)ΔH=+571.6 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com