
 纳米级TiO2是一种光催化材料,可处理甲醛、氮氧化物等污染物,工业上也可用其催化乙醇脱氢制备乙醛:CH3CH2OH$\stackrel{TiO_{2}}{→}$CH3CHO+H2↑.
纳米级TiO2是一种光催化材料,可处理甲醛、氮氧化物等污染物,工业上也可用其催化乙醇脱氢制备乙醛:CH3CH2OH$\stackrel{TiO_{2}}{→}$CH3CHO+H2↑.分析 (1)Ti是22号元素,所以Ti原子基态核外电子排布式为[Ar]3d24s2;
(2)CH3CHO分子中甲基上饱和碳,而醛基上是不饱和碳;双键中一个π键、一个σ键;
(3)互为等电子体的一种微粒具有相同的价电子数和原子数;
(4)分子间氢键的存在物质的熔沸点升高;
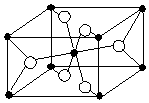
(5)TiO2的晶胞结构中黑球的个数是$\frac{1}{8}×8$+1=2,而空心球的个数为:4×$\frac{1}{2}$+2=4,而化学式为TiO2,所以空心球是氧原子,所以每个氧原子直接相连的钛原子数目为3个.
解答 解:(1)Ti是22号元素,所以Ti原子基态核外电子排布式为[Ar]3d24s2,故答案为:[Ar]3d24s2;
(2)CH3CHO分子中甲基上饱和碳,是sp3 杂化,而醛基上是不饱和碳,是sp2杂化,1molCH3CHO分子中含有 σ键的数目为6mol,故答案为:sp2、sp3;6mol;
(3)与NO分子互为等电子体的一种微粒具有相同的价电子数11和原子数2,微粒为O2+,故答案为:O2+;
(4)乙醇可以与水以任意比互溶,除因为它们都是极性分子外,还因为CH3CH2OH与H2O分子之间可以形成氢键,
故答案为:CH3CH2OH与H2O分子之间可以形成氢键;
(5)TiO2的晶胞结构中黑球的个数是$\frac{1}{8}×8$+1=2,而空心球的个数为:4×$\frac{1}{2}$+2=4,而化学式为TiO2,所以空心球是氧原子,所以每个氧原子直接相连的钛原子数目为3个,故答案为:3.
点评 本题考查了价电子排布、化学键的类型、原子杂化方式、氢键等知识,有一定的综合性,题目中等难度,注意基础知识的运用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题

| A. | 交换膜Ⅰ为阴离子交换膜,A-从浓缩室通过向阳极移动 | |
| B. | 交换膜Ⅱ为阴离子交换膜,H+从浓缩室通过向阴极移动 | |
| C. | 阳极的电极反应式为2H2O-4e-═4H++O2↑ | |
| D. | 400mL0.1mol•L-1乳酸溶液通电一段时间后,浓度上升到0.6mol•L-1,则阴极上产生的H2在标准状况下的体积为4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
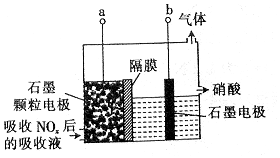
| A. | 吸收NOx的过程涉及氧化还原反应 | |
| B. | 石墨电极为颗粒状,可增大接触面积,提高电解效率 | |
| C. | 当b极上产生2.8 L(标准状况)H2时,转移的电子数为0.5NA(设NA为阿伏加德罗常数的数值) | |
| D. | a极的电极反应式为HNO2-2e-+H2O═3H++NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电子从b流出,经外电路流向a | |
| B. | HS在硫氧化菌作用下转化为SO42-的反应是HS-+4H2O-8e-═SO42-+9H+ | |
| C. | 如果将反应物直接燃烧,能量的利用率不会变化 | |
| D. | 若该电池电路中有0.4mol电子发生转移,则有0.5mol H+通过质子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向甲、乙、丙三个恒容密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).相关数据如表,反应过程中C的浓度随时间变化关系如图.下列说法正确的是( )
向甲、乙、丙三个恒容密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).相关数据如表,反应过程中C的浓度随时间变化关系如图.下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6 mol A 2 mol B |
| A. | T1>T2,x=1 | |
| B. | T2℃时,该反应的平衡常数为0.8 | |
| C. | A的平衡转化率a(甲):a(乙)=2:3 | |
| D. | 15~20min内C的平均反应速率v(乙)<v(丙) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
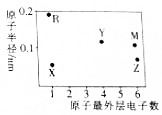 X、Y、Z、M、R为五种短周期主族元素,其原子半径和最外层电子数之间的关系如图所示.下列说法正确的是( )
X、Y、Z、M、R为五种短周期主族元素,其原子半径和最外层电子数之间的关系如图所示.下列说法正确的是( )| A. | 五种元素位于同一周期 | |
| B. | 简单离子半径:M<R | |
| C. | Y、Z形成的常见化合物中存在离子键 | |
| D. | 气态氢化物的稳定性、沸点均有Z>M |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高二上第一次月考化学试卷(解析版) 题型:实验题
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
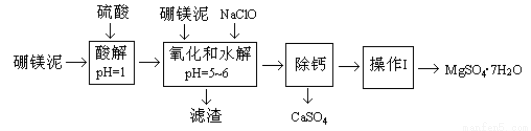
根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有 。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有 。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式 。
在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为 。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法 。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤 、 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一上第一次月考化学试卷(解析版) 题型:填空题
(1)相同物质的量的O2和O3的质量比为___________。
(2)2.5 mol Ba(OH)2中含有__________个OH—,2.5 mol Ba(OH)2的质量是___________g。
(3)在标准状况下,1.7 g氨气所占的体积约为___________L,它与标准状况____________L硫化氢含有相同数目的氢原子。
(4)某气态氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为_____________。
(5)同温同压下,SO2与氦气的密度之比为___________,若质量相同,两种气体的体积比为___________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省新乡市高二上第一次月考化学卷(解析版) 题型:选择题
沼气是一种能源,它的主要成分是CH4。0.5 mol CH4完全燃烧生成CO2和液态水时放出445 kJ的热量,则下列热化学方程式中正确的是( )
A.2CH4(g)+4O2(g)==2CO2(g)+4H2O(l) ΔH=+890 kJ·mol-1
B.CH4(g)+2O2(g)==CO2(g)+2H2O(l) ΔH=+890 kJ·mol-1
C.CH4(g)+2O2(g)==CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
D. 1/2CH4(g)+O2(g)==1/2CO2(g)+H2O(l) ΔH=-890 kJ·mol-1[来源:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com