
【题目】氨气有广泛用途,工业上利用反应N2(g)+3H2(g)![]() 2NH3(g) H<0合成氨,回答以下问题:
2NH3(g) H<0合成氨,回答以下问题:
(1)某小组为了探究外界条件对反应的影响,以c0 mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图A。
①a条件下,0~t0的平均反应速率v(H2)=_____________mol·L-1·min-1。
②相对a而言,b可能改变的条件是________________。
③在a条件下t1时刻将容器体积压缩至原来的1/2,t2时刻重新建立平衡状态。请在答题卡相应位置画出t1时刻后c(H2)的变化曲线并作相应的标注。_____________
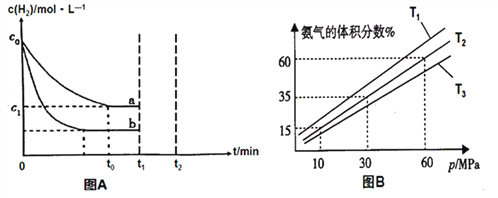
(2)某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反应,图B为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。
① 比较T1、T3的大小T1__________T3(填“<”或“>”)。
②分析体系在T2、60MPa下达到的平衡,此时N2的平衡分压为_______MPa(分压=总压×物质的量分数);列式表示此时的平衡常数Kp=______________。(用平衡分压代替平衡浓度,不要求计算结果)
(3)有人利用NO2和NH3构成电池的方法,既能实现有效消除氮氧化物的排放减少环境污染,又能充分利用化学能进行粗铜精炼,如图C所示,d极为粗铜。
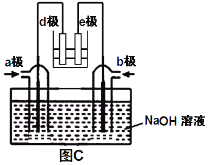
① a极通入________(填化学式);
② b极电极反应为_____________________________。
【答案】 (c0-c1)/t0 增大c(N2)  < 9
< 9 ![]() NO2 2NH3—6e—+6OH—=N2+6H2O
NO2 2NH3—6e—+6OH—=N2+6H2O
【解析】(1)①根据图像可知,0~t0的平均反应速率v(H2)=(c0-c1)/t0 mol·L-1·min-1;正确答案:(c0-c1)/t0。
②从图像可出:达到平衡时,氢气的平衡浓度变小,时间缩短,速率加快;增大压强,平衡右移,但是氢气浓度增大,与题意矛盾;增加氮气的浓度,平衡右移,氢气的转化率增大,速率加快,符合题意;正确答案:增大c(N2)。
③体积缩小1/2,氢气的浓度会从c1突增到2 c1,然后根据缩小体积、增大压强,平衡右移,氢气的浓度减少但始终在c1与2 c1之间;正确答案: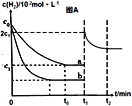 。
。
(2)①该反应为放热反应,当压强不变的情况下,降低温度,平衡右移,氨气的体积分数增大,从图像看出,T1小于T3;正确答案:<。
②设氮气的变化量为xmol,根据反应
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始量 9 23 0
变化量 x 3 x 2 x
平衡量 9- x 23-3x 2 x
氨气的体积分数= 2x÷(9- x+ 23-3x+2x)=60%,解之x=6mol;把x=6带入下式可得:N2的物质的量分数=(9- x)÷(9- x+ 23-3x+2x)=3/20,此时N2的平衡分压为60×3/20=9;H2的物质的量分数=(23-3x)÷(9- x+ 23-3x+2x)=1/4, 此时H2的平衡分压为60×1/4=15;NH3的物质的量分数60%,此时NH3的平衡分压为60×60%=36;此时的平衡常数Kp=![]() ;正确答案:9;
;正确答案:9;![]() 。
。
(3)粗铜精炼中,粗铜做电解池的阳极,因此与d 极相连的a极为原电池的正极,发生还原反应,NO2和NH3反应生成氮气和水,NO2中+4价氮元素降低到0价,被还原;因此a极通入NO2;b极为原电池的负极,氨气在此极发生氧化反应生成氮气,极反应为2NH3—6e—+6OH—=N2+6H2O;正确答案:NO2;2NH3—6e—+6OH—=N2+6H2O。


科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0L的恒容密闭容器中分别加入一定量的X,发生反应:pX(g) ![]() Y(g)+Z(g),相关数据如下表所示:
Y(g)+Z(g),相关数据如下表所示:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
X(g) | Y(g) | Z(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | 0.160 | 0.160 |
Ⅲ | T | 0.20 | 0.090 | 0.090 |
回答下列问题:
(1)若容器Ⅰ中反应经10min达到平衡,则前10min内Y的平均反应速率v(Y)=___________。容器Ⅰ和容器Ⅱ中起始时X的反应速率v(X)Ⅰ___________v(X)Ⅱ(填“大于”“小于”或“等于”)。
(2)已知该正反应为放热反应,则T___________387(填“大于”或“小于”),判断理由是___________。
(3)反应方程式中X的化学计量数p的取值为___________,容器Ⅱ中X的平衡转化率为___________。若起始时向容器Ⅰ中充入0.1molX、0.15molY和0.10molZ,则反应将向___________ (填“正”或“逆”)反应方向进行,判断理由是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知几种难溶电解质的溶度积如下表所示:
几种难溶电解质的Ksp(25℃) | |
沉淀溶解平衡 | Ksp |
AgBr(s) | 5,0×10-13 mol2·L-2 |
AgI(s) | 8.3×10-17 mol2·L-2 |
FeS(s) | 6.3×10-18 mol2·L-2 |
ZnS(s) | 1.6×10-24 mol2·L-2 |
CuS(s) | 1.3×10-36 mol2·L-2 |
(1)AgBr、AgI、FeS、ZnS、CuS的溶解能力由大到小的顺为:____________________。
(2)向饱和的AgI溶液中加入固体硝酸银,则c( I- )________(填“增大”、“减小”或“不变”),若改加AgBr固体,则c(Ag+)__________(填“增大”、“减小”或“不变”)。
(3)在25℃时,向100mL浓度均为0.1 mol·L-1 FeCl2、ZnCl2、CuCl2的混合溶液中逐滴加入Na2S溶液,生成的沉淀的先后顺序是_____________________(用沉淀物的化学式表示)。
(4)在25℃时,把ZnS加入蒸馏水中,一定时间后达到如下平衡: ZnS(s)![]() Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是 _______。
Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是 _______。
A.加入少量CuS固体 B.加入少量FeS固体
C.加入少量FeCl2固体 D.加入少量CuCl2固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的事实是
A. 碳酸钙不溶于水,但溶于盐酸
B. 由2NO2(g)![]() N2O4(g)组成的平衡体系,加压后颜色加深
N2O4(g)组成的平衡体系,加压后颜色加深
C. 高压比常压有利于合成氨的反应
D. 用热的纯碱溶液洗油污时,去污效果好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知A、B、C、D、E五种元素是元素周期表中前四周期元素,且原子序数依次增大,其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子。 D、E 为同周期元素且分别位于s区和d区。五种元素所有的s能级电子均为全充满。E的d能级电子数比A、B、C最高能层的P能级电子数之和少一个。回答下列问题:
(1)五种元素中,电负性最大的是___________________(填元素符号)。
(2)E常有+2、+3两种价态,写出E2+的最外层电子排布式________________________。
(3)自然界中,含A的钠盐是一种天然矿藏,其化学式写作Na2A4O7·10H2O,实际上它的结构单元是由两个H3AO3和两个[A(OH)4]-缩合而成的双六元环,应该写成Na2A4O5(OH)4·8H2O,其结构如图1。①A原子的杂化轨道类型为_______________________________。
②该阴离子由极性键和配位键构成,请在图1中用“→”标出其中的配位键____________。
③已知H3AO3为一元弱酸,根据上述信息,用离子方程式解释分析H3AO3为一元酸的原因(用元素符号表示)____________________________________。
(4)①写出ECl3与苯酚(C6H5OH)反应生成[E(OC6H5)6]3-的化学方程式:________________________。
②请从分子结构的角度解释苯酚室温下在水中的溶解度小,当温度高于65℃时,能与水混溶:_______________________________________________________。
(5)由元素B、D组成的某离子化合物的晶胞结构如图2,写出该物质的电子式_____________________,若晶胞的长、宽、高分别为520pm、520pm和690pm,该晶体密度为______________g/cm3(保留到小数点后两位)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为①2MoS2+7O2![]() 2MoO3+4SO2;②MoO3+2NH3·H2O====(NH4)2MoO4+H2O;③(NH4)2MoO4+2HCl====H2MoO4↓+2NH4Cl;④H2MoO4
2MoO3+4SO2;②MoO3+2NH3·H2O====(NH4)2MoO4+H2O;③(NH4)2MoO4+2HCl====H2MoO4↓+2NH4Cl;④H2MoO4![]() MoO3+H2O;⑤用还原剂将MoO3还原成金属钼。
MoO3+H2O;⑤用还原剂将MoO3还原成金属钼。
则下列说法正确的是
A. MoS2煅烧产生的尾气可直接排空
B. MoO3是金属氧化物,也是碱性氧化物
C. H2MoO4是一种强酸
D. 利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的描述你认为正确的是:
A.含碳元素的化合物一定是有机化合物
B.乙烷和乙烯互为同系物
C.苯分子含有碳碳双键,所以可以使酸性高锰酸钾褪色
D.正丁烷和异丁烷互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为五种气态烃,其中A、B、C都能使酸性高锰酸钾溶液褪色;1mol C能与2mol Br2完全加成,生成物分子中每个碳原子上有一个溴原子;A与C具有相同的通式;A与H2加成可得B,B与相同条件下N2的密度相同;D是最简单的有机物,E是D的同系物,完全燃烧相同物质的量的B或E生成CO2的量相同。
(1)试确定A、B、C、D、E的结构简式:
A:_____;B:_____;C:_____;D:_____;E:_____。
(2)等质量的A、B、C、D、E完全燃烧,耗氧量最多的是______(填名称,下同)生成二氧化碳最多的是______。
(3)等物质的量的A、B、C、D、E完全燃烧,耗氧量最多的是____(填名称,下同),生成水最多的是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com