
| A. | 1:6 | B. | 1:7 | C. | 2:11 | D. | 16:25 |
分析 根据FeS化学式可知,溶液中铁离子与硫酸根离子的物质的量相等,令参加反应的FeS为1mol,则溶液中Fe2(SO4)3为$\frac{1}{3}$mol,Fe(NO3)3为$\frac{1}{3}$mol,反应中Fe元素、S元素化合价升高,N元素化合价降低,根据电子转移守恒计算NO2、N2O4、NO各的物质的量,进而计算起氧化剂作用的HNO3,参加反应的硝酸为起氧化剂作用的硝酸与起酸作用的硝酸之和,据此计算.
解答 解:令参加反应的FeS为1mol,则溶液中Fe2(SO4)3为$\frac{1}{3}$mol,Fe(NO3)3为$\frac{1}{3}$mol,
反应中Fe元素、S元素化合价升高,N元素化合价降低,令NO2、N2O4、NO的物质的量分别为amol、amol、amol,根据电子转移守恒有:1×(3-2)+1×[6-(-2)]=a×(5-4)+a×(5-4)×2+a×(5-2),解得a=1.5,故NO2、N2O4、NO的物质的量分别为1.5mol、1.5mol、1.5mol,故起氧化剂作用的HNO3为1.5mol+1.5mol×2+1.5mol=6mol,起酸的作用的硝酸生成Fe(NO3)3,故起酸的作用的硝酸为$\frac{1}{3}$mol×3=1mol,参加反应的硝酸为6mol+1mol=7mol,故实际参加反应的FeS与HNO3的物质的量之比为1mol:7mol=1:7,
故选B.
点评 本题考查氧化还原反应有关计算,难度中等,利用电子转移守恒与元素守恒计算是关键,转移守恒思想在氧化还原反应计算中的运用.


科目:高中化学 来源: 题型:解答题
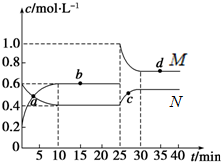 W、X、Y、Z分别为H、C、N、O元素.
W、X、Y、Z分别为H、C、N、O元素.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
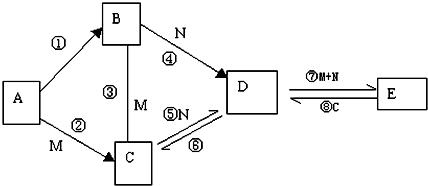
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质溶液导电的过程实际上就是电解的过程 | |
| B. | 利用电解饱和食盐水所得的产物可以生产盐酸 | |
| C. | 铜在酸性环境中易发生析氢腐蚀 | |
| D. | 氢氧燃料电池的负极通入的是氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种气体的分子个数之比为17:16 | |
| B. | 两种气体的原子个数之比为17:16 | |
| C. | 两种气体的氢原子个数之比为17:12 | |
| D. | 同温同压下,两种气体的体积之比为17:16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | b极为电池的负极 | |
| B. | 当1mol乙醇被氧化转移12NA个电子 | |
| C. | 电池工作时电流由a极沿导线经灯泡再到b极 | |
| D. | 电池正极的电极反应为:O2+4e-+2H2O=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35.6% | B. | 27% | C. | 10% | D. | 73% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则表示氢气燃烧热的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| C. | 温度、浓度的改变一定会引起反应速率的改变,所以化学平衡一定会移动 | |
| D. | 酸与碱恰好完全反应生成正盐,其中c(H+)=c(OH-)=10-6 mol/L的溶液一定呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的PH>7.
向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的PH>7.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com