
下列说法或操作不正确的是()
A. 某些强氧化剂(如氯酸钾、高锰酸钾等)或其混合物不能研磨,否则易引起爆炸
B. 达到滴定终点后,静置1〜2min再读数,主要是为了防止管壁有液体残留引起误差
C. 在用简易量热计测定反应热时,一般采取下列实验措施:使用碎泡沫起隔热保温、用玻璃棒进行搅拌,准确读取反应前后温度、取2〜3次的实验平均值
D. 某溶液可能含有SO42-和Cl-可先加足量的硝酸钡,取上层清液再加稀硝酸和硝酸银来检验其中的Cl-
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源:2016-2017学年安徽省高二上第一次月考化学试卷(解析版) 题型:选择题
T℃时,体积均为0.5 L的两个恒容密闭容器中发生可逆反应:2A(g)+B(g) 2C(g) △H= -Q kJ/mol(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如下表:
2C(g) △H= -Q kJ/mol(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 达到平衡时体系能量的变化 | ||
A | B | C | ||
① | 2 | 1 | 0 | 0.75Q kJ |
② | 0.4 | 0.2 | 1.6 | |
下列叙述中正确的是
A.容器①、②中反应的平衡常数均为18
B.容器②中达到平衡时放出的热量为0.05Q kJ
C.向容器①中通入氦气,平衡时A的转化率变大
D.其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于2/3
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三联合考试化学试卷(解析版) 题型:选择题
下列实验中,对应的现象以及结论都正确的是
选项 | 实验 | 现象 | 结论 |
A | 向酸性KMnO4溶液中滴加H2O2溶液至过量 | 紫色消失 | H2O2在该反应中作还原剂 |
B | 溶有SO2的BaCl2溶液中通入气体X | 有白色沉淀生成 | X一定是Cl2 |
C | 向FeBr2和KSCN混合溶液中滴入少量新制氯水,再加入CCl4混合振荡、静置 | 有机相呈红棕色,水相呈无色 | Fe2+的还原性大于Br- |
D | 铝丝用砂纸打磨后,放在冷的浓硝酸中浸泡一段时间后,放入CuSO4溶液中 | 铝丝表面变红色 | 铝可从铜盐溶液中置换出铜 |
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第一次联考化学试卷(解析版) 题型:选择题
下列各组离子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式正确的是()
选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
A | Fe2+、NO3-、NH4+ | NaHSO4溶液 | 3Fe2++NO3- +4H+=3 |
B | Ca2+、HCO3-、Cl- | 少量NaOH溶液 | Ca2++2HCO3- +2OH-=2H2O+CaCO3↓+CO32- |
C | K+、AlO2-、HCO3- --来源:Zxxk.Com] | 通入少量CO2 | 2Al |
D | NH4+、Al3+、SO42- | 少量Ba (OH) 2溶液 | 2NH4+ |
A.A B.B C. C D.D
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第一次联考化学试卷(解析版) 题型:选择题
安全是顺利进行实验及避免伤害的保障.下列实验操作正确且不是从实验安全角度考虑的是( )

A. 操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B. 操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
C. 操作③:吸收氨气或氯化氢气体并防止倒吸
D. 操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
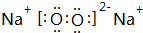
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com