
 密闭容器中发生如下反应:A(g)+3B(g)?2C(g)△H<0,根据下列速率-时间图象,回答下列问题.
密闭容器中发生如下反应:A(g)+3B(g)?2C(g)△H<0,根据下列速率-时间图象,回答下列问题. 分析 该反应为气体体积减小、放热的反应,由图可知,t0~t1为原平衡,t1~t2时正逆反应速率均增大,且平衡逆向移动,则改变条件为升高温度;t3~t4时正逆反应速率均增大,且平衡不移动;t4~t5时正逆反应速率均减小,且平衡逆向移动,则改变条件为减小压强,平衡逆向移动导致C的百分含量减小,则t0~t1时C的百分含量最高,以此来解答.
解答 解:(1)由上述分析可知,改变条件分别为t1为升高温度;t3为使用催化剂;t4 为减小压强,
故答案为:升高温度;使用催化剂;减小压强;
(2)t0~t1为原平衡,t2~t3时平衡逆向移动,t3~t4时平衡不移动;t4~t5时平衡逆向移动,平衡逆向移动导致A的体积分数变大,则t5~t6时A的体积分数最大,
故答案为:t5~t6;
(3)t2~t3时平衡逆向移动,t3~t4时平衡不移动,则图象中C的体积分数相等的时间段是t2~t3、t3~t4,
故答案为:t2~t3、t3~t4;
(4)由图可知,纵坐标为反应速率,则反应速率最大的时间段是t3~t4,
故答案为:t3~t4;
(5)K与温度有关,该反应为放热反应,升高温度平衡逆向移动导致K减小,则t1为升高温度,其它时间段温度不变,则K0>K3=K5,
故答案为:K0>K3=K5.
点评 本题考查化学平衡移动、化学反应速率及平衡的图象,为高频考点,把握温度、浓度、压强对平衡移动及速率的影响为解答本题关键,侧重分析与应用能力的考查,注意速率与平衡移动的关系,(5)为解答的难点,题目难度不大.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧元素的相对原子质量是$\frac{12a}{b}$ | |
| B. | 1 mol该氧原子质量是aNA | |
| C. | xg该氧原子所含的电子数为$\frac{8x}{a}$,即物质的量为$\frac{8x}{a{N}_{A}}$ | |
| D. | yg该氧原子的中子数一定为$\frac{8y}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.
运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在一密闭容器中发生反应N2(g)+3H2(g)?2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
在一密闭容器中发生反应N2(g)+3H2(g)?2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 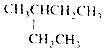 2-乙基丁烷 2-乙基丁烷 | B. | CH3CHBr2 二溴乙烷 | ||
| C. | 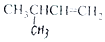 2-甲基丁烯 2-甲基丁烯 | D. |  苯甲醇 苯甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com