
 碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:
碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:分析 (1)根据盖斯定律以及热化学方程式的意义来解答;
(2)①结合题干计算铁物质的量,根据化学方程式定量关系计算甲烷消耗的物质的量,依据化学反应速率概念计算得到;
②反应达到平衡状态时,正逆反应速率相等,各组分浓度保持不变,据此分析;
③该反应是正反应气体体积增大的吸热反应,升温平衡正向移动,据此分析;
(3)①②HNO2是弱酸,次氯酸电离是吸热反应,酸碱中和反应是放热反应,当恰好完全中和时放出热量最多,据此确定c(NaOH);
③电离吸热,温度越高电离平衡常数越大;
④当c(NaOH)较大时,可能出现:c(Na+)>c(OH-)>c(NO2-)>c(H+).
解答 解:(1)CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1 ①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2 ②
根据盖斯定律得:2CH4(g)+4NO2(g)=2CO2(g)+4H2O(g)+2N2(g)△H1+△H2
而 1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,所以△H1+△H2=-1734kJ•mol-1,则△H2=-1734kJ•mol-1+574kJ•mol-1=-1160 kJ•mol-1,
故答案为:-1160kJ•mol-1;
(2)①若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g的物质的量=$\frac{3.2g}{160g/mol}$=0.02mol,结合化学方程式,Fe2O3(s)+3CH4(g)═2Fe(s)+3CO(g)+6H2(g),计算反应的甲烷物质的量为0.06mol,则该段时间内CH4的平均反应速率=$\frac{\frac{0.06mol}{5L}}{1min}$=0.012mol/(L•min);
故答案为:0.012mol/(L•min);
②A.CH4的转化率与CO的产率与是否达到平衡状态无关,故A错误;
B.反应前后气体的物质的量和质量都不同,所以混合气体的平均相对分子质量不变说明反应达到平衡状态,故B正确;
C、v(CO)与v(H2)的比值始终不变,所以其不能说明反应达到平衡状态,故C错误;
D、固体的总质量不变,说明正逆反应速率相等,反应达到平衡状态,故D正确;
故答案为:BD;
③Fe2O3(s)+3CH4(g)═2Fe(s)+3CO(g)+6H2(g)△H>0,反应是气体体积增大的吸热反应,升温平衡正向移动,平衡常数增大,KA<KB;
A.H2的逆反应速率随温度的升高而增大,故A错误;
B.升温平衡正向移动,CH4的体积分数减小,故B正确;
C.升温平衡正向移动,混合气体的平均相对分子质量减小,故C正确;
D.升温平衡正向移动,CO的体积分数增大,故D错误;
故答案为:<;BC;
(3)①HNO2是弱酸,次氯酸电离是吸热反应,酸碱中和反应是放热反应,当恰好完全中和时放出热量最多,c(NaOH)=$\frac{0.020L×0.01mol/L}{0.020L}$=0.01mol/L;
故①错误,②正确;
③电离吸热,温度越高电离平衡常数越大,所以HNO2的电离平衡常数:b点>a点,故③正确;
④从b点到c点,当C(NaOH)较大时,可能出现:c(Na+)>c(OH-)>c(NO2-)>c(H+),故错误;
故答案为:②③.
点评 本题综合考查学生有关电化学、热化学、化学反应速率和平衡的有关计算等知识,综合性较强,难度大.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | 钠质软,可用小刀切割 | |
| B. | 钠在空气中燃烧生成白色的过氧化钠 | |
| C. | 热的纯碱溶液可以除去铜片表面的油污 | |
| D. | 碳酸氢钠是焙制糕点所用发酵粉的主要成分之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中n(Fe2+)与n(Fe3+)之比为6:1 | |
| B. | 氧化产物与还原产物的物质的量之比为2:5 | |
| C. | 铁有剩余,溶液呈浅绿色,c(Cl-)基本不变 | |
| D. | 往溶液中滴加无色KSCN溶液,不变色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=14的溶液中:CO32-、Na+、S2-、AlO2- | |
| B. | 室温下水电离的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| C. | 室温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:Fe2+、Al3+、NO3-、I- | |
| D. | 无色溶液中:Al3+、NH4+、Cl?、HCO3? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将金属A投入B的盐溶液,A溶解说明A的金属性比B的金属性强 | |
| B. | 氯碱工业和金属钠的冶炼都用到了NaC1,在电解时它们的阴极都是Na+得电子 | |
| C. | 向硫酸溶液中加入适量氨水,当溶液中c(SO42-)=c(NH4+)时,溶液呈酸性 | |
| D. | 等物质的量浓度的下列溶液中①NH4Cl ②NH4Al(SO4)2 ③NH3•H2O ④CH3COONH4,c(NH4+)由大到小的顺序是:①>②>③>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2使紫色石蕊溶液变红色:SO2+H2O═2H++SO32- | |
| B. | 在任何条件下都不能发生Cu+H2SO4═CuSO4+H2↑反应 | |
| C. | FeCl3、Na2O2、Cu2S均可由相应单质直接化合生成 | |
| D. | 浓度和体积相同的FeBr2、FeI2溶液中,分别通入少量氯气都首先发生置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
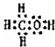 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述过程中,最终被还原的是NO3- | |
| B. | 从上述过程中可以得出结论,氧化性:HNO3>稀H2SO4>Fe3+ | |
| C. | 上述过程中,会产生一种无色无味的难溶于水的气体 | |
| D. | 若通入的SO2完全反应,则同温同压下,SO2和逸出气体的体积为3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是( )
水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是( )| A. | 改变条件使纯水的pH值减小,其酸性增强 | |
| B. | 100℃时某溶液中由水电离产生的c(H+)=1×10-11 mol•L-1,则该溶液的pH可能是11或3 | |
| C. | 将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10:1 | |
| D. | 100℃时,pH值均为8的醋酸钠和氨水两溶液中,水的电离程度之比为104:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com