
下列说法或表述正确的是
| A.由水电离产生的c(H+)=1×10-2mol?L-1溶液中,可能存在:CO32-、NH4+、Cl-、Na+ |
| B.某醋酸稀溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| C.Ba(OH)2溶液中加人过量的Al2(SO4)3溶液,其离子方程式为: 3Ba2++6OH- +2Al3++3SO42-=3BaS04↓+2Al(OH)3↓ |
| D.物质的量浓度均为1 mol?L-1的NaCl和MgCl2混合液中,含有Cl-的数目为3NA(NA表示阿伏加德罗常数的值) |
C
解析试题分析:A、由水电离产生的c(H+)=1×10-2mol?L-1溶液中,说明该溶液中水的电离平衡是被促进的。因此溶液可能显酸性也可能显碱性。如果显酸性,则CO32-不能大量共存;如果显碱性,则NH4+不能大量共存,A不正确;B、醋酸是弱酸,存在电离平衡,稀释促进电离,但溶液的酸性降低。因此某醋酸稀溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a<b,B不正确;C、硫酸铝过量时,与氢氧化钡反应的离子方程式是3Ba2++6OH- +2Al3++3SO42-=3BaS04↓+2Al(OH)3↓,C正确;D、氯化钠和氯化镁溶液的体积不能确定,因此不能计算溶液中氯离子的个数,D不正确,答案选C。
考点:考查离子共存、弱电解质的电离平衡、离子方程式以及阿伏加德罗常数的有关计算等


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
已知25℃时:
① NH4+ (aq)+OH-(aq)=NH3·H2O(aq) ΔH="a" kJ·mol-1
② NH4+ (aq)+H2O(1)  NH3·H2O(aq)十H+(aq) ΔH=bkJ·mol-1向20mL0.1mol/L氨水中逐滴加入0.1mol/L盐酸,下列有关说法正确的是
NH3·H2O(aq)十H+(aq) ΔH=bkJ·mol-1向20mL0.1mol/L氨水中逐滴加入0.1mol/L盐酸,下列有关说法正确的是
A.水电离过程的热化学方程式可表示为:H2O(1)  H+(aq)+OH-(aq) ΔH=(a-b)KJ/mol H+(aq)+OH-(aq) ΔH=(a-b)KJ/mol |
| B.当滴入10mL盐酸时,溶液中:c(NH4+)+c(NH3·H2O)=2c(Cl-) |
| C.随着盐酸的逐滴加入,水电离的c(OH-)总是逐渐减小 |
| D.当滴入20 mL盐酸时,溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
碳酸有两个电离常数Ki1、Ki2,分别对应碳酸的两步电离。关于Ki1和Ki2说法正确的是
A.Ki1的表达式为 |
B.Ki2对应的电离过程是HCO3— + H2O 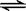 H3O+ + CO32— H3O+ + CO32— |
| C.当碳酸的电离平衡正向移动时,Ki1与Ki2均相应增大 |
| D.改变条件使Ki1减小,则Ki2一定也减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| B.浓度均为0.1mol·L-1的下列溶液,pH由大到小排列顺序为NaOH>Na2CO3>NaHSO4>(NH4)2SO4 |
| C.pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比为1:2 |
| D.向冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,用Na2SO3溶液吸收SO2时,溶液pH随n(SO32-):n(HSO3-)变化的关系如下表:
| n(SO32-):n(HSO3-) | 91:1 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关溶液中微粒浓度关系的叙述正确的是
| A.向0.1 mol·L-1NH4Cl溶液中通入一定量氨气后:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B.溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(C1O-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| C.向CH3COONa溶液中滴加稀HCl至中性,所得溶液中:c(Cl-)>c(Na+)>c(CH3COOH) |
| D.等物质的量浓度CH3COOH溶液和CH3COONa溶液等体积混合,所得溶液中:c(CH3COOH)+2c(OH-)=2c(H+)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关溶液的说法正确的是
| A.向10mLpH=3的酣酸溶液中加入10mLpH=l1的NaOH溶液,混合液的pH=7 |
| B.实验测定NH4HCO3溶液显碱性,CH3COONH4溶液显中性,说明酸性CH3COOH>HCO3 |
| C.NH4CI溶液加水稀释过程中c(H+)+c(NH3·H2O)=c(OH一) |
| D.向AgI沉淀中加人饱和KCl溶液,有白色沉淀生成,说明AgCl比AgI更难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向20mL 0.5mol/L的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法错误的是
| A.醋酸的电离平衡常数:b点>a点 |
| B.由水电离出的c(OH—):b点>c点 |
| C.从a点到b点,混合溶液中可能存在:c(CH3COO—)= c(Na+) |
| D.b点到c点,混合溶液中一直存在:c(Na+)>c(CH3COO—)>c(OH—)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,将V1mL c1mol/L的醋酸滴加到V2mL c2mol/L的氢氧化钠溶液中,下列结论正确的是
| A.若将c1mol/L的醋酸冲稀10倍,则其pH增大1 |
| B.若将c2 mol/L的氢氧化钠溶液冲稀10倍,则其pH减小1 |
| C.若c1? V1=c2?V2,则混合液中c(CH3COO-)=c(Na+) |
| D.若混合液的pH=7,则混合液中c(CH3COO-)=c(Na+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com