
【题目】二氧化碳的回收利用是环保领域研究热点。
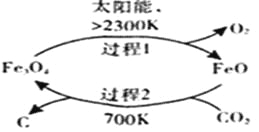
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如右图所示。总反应的化学方程式为 。
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2![]() CH3OH+H2O。已知298K和101KPa条件下:
CH3OH+H2O。已知298K和101KPa条件下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l) △H=-a kJ·mol-1;
CH3OH(g)+H2O(l) △H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(l) △H=-b kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-c kJ·mol-1,
则CH3OH(l)的标准燃烧热△H=___________________。
(3)CO2经过催化氢化合成低碳烯烃,合成乙烯反应为
2CO2 (g)+ 6H2(g)![]() CH2= CH2(g) +4H2O(g) △H<0
CH2= CH2(g) +4H2O(g) △H<0
在恒容密闭容器中充入2 mol CO2和n mol H2,在一定条件下发生反应,CO2的转化率与温度、投料比![]() 的关系如右图所示。
的关系如右图所示。
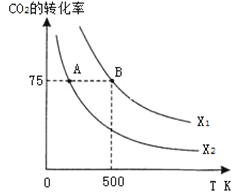
①平衡常数KA KB
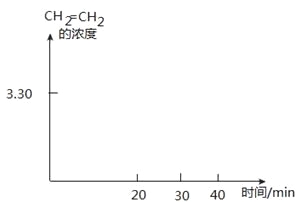
②T K时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如下:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
CH2=CH2(g) | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
20~30 min间只改变了某一条件,根据上表中的数据判断改变的条件可能是
A.通入一定量H2B.通入一定量CH2=CH2
C.加入合适催化剂 D.缩小容器体积
画出CH2=CH2的浓度随反应时间的变化曲线。
(4)在催化剂M的作用下,CO2和H2同时发生下列两个反应
A.2CO2 (g)+ 6H2(g)![]() CH2= CH2(g) +4H2O(g) △H< 0
CH2= CH2(g) +4H2O(g) △H< 0
B.2CO2(g) + 6H2(g)![]() CH3OCH3(g)+3H2O(g) △H< 0
CH3OCH3(g)+3H2O(g) △H< 0
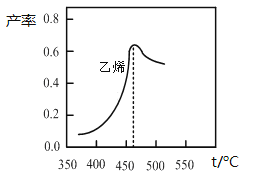
上图是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因不可能是
A.催化剂M的活性降低 B.A反应的平衡常数变大
C.生成甲醚的量增加 D.B反应的活化能增大
(5)Na2CO3溶液也通常用来捕获CO2。常温下,H2CO3的第一步、第二步电离常数分别约为Ka1=4×10-7 ,Ka2=5×10-11,则0.5mol·L-1的Na2CO3溶液的pH等于 (不考虑第二步水解和H2O的电离)
【答案】(1)![]() (见氧化亚铁才给分);
(见氧化亚铁才给分);
(2)a+c-1.5b kJ·mol-1 ;(3) ①> ② D ③
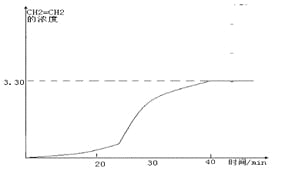 (在20-30分钟内曲线突然变陡);
(在20-30分钟内曲线突然变陡);
(4)BD; (5)12
【解析】试题分析:(1)根据在太阳能的作用下,以CO2为原料制取炭黑的流程图可知,反应的原理为:![]() ,答案为:
,答案为:![]() ;(2)CH3OH(l)的标准燃烧热是指1molCH3OH(l)完全燃烧生成稳定氧化物,放出的热量,热化学方程式为:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H,已知反应①CO2(g)+3H2(g)
;(2)CH3OH(l)的标准燃烧热是指1molCH3OH(l)完全燃烧生成稳定氧化物,放出的热量,热化学方程式为:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H,已知反应①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l) △H1=-a kJ·mol-1;②2H2(g)+O2(g)=2H2O(l) △H2=-b kJ·mol-1;③CH3OH(g)=CH3OH(l) △H3=-c kJ·mol-1,上述反应可以由反应①+③-3/2②得到,根据盖斯定律,甲醇的燃烧热△H= a+c-1.5b kJ·mol-1 ,答案为:a+c-1.5b kJ·mol-1 ;(3)温度升高化学平衡向吸热反应移动,该反应为放热反应,温度越低,平衡常数越大,所以有KA>KB,答案为:>;②从表格中可以看出氢气和二氧化碳的浓度先增大,后又减小,但最终的浓度是增大的,乙烯的浓度始终在增大,说明化学平衡横向移动,各物质的量浓度增大、平衡正向移动,说明是缩小容器的体积,答案为:D;③根据表格可以画出CH2=CH2的浓度随反应时间的变化曲线:
CH3OH(g)+H2O(l) △H1=-a kJ·mol-1;②2H2(g)+O2(g)=2H2O(l) △H2=-b kJ·mol-1;③CH3OH(g)=CH3OH(l) △H3=-c kJ·mol-1,上述反应可以由反应①+③-3/2②得到,根据盖斯定律,甲醇的燃烧热△H= a+c-1.5b kJ·mol-1 ,答案为:a+c-1.5b kJ·mol-1 ;(3)温度升高化学平衡向吸热反应移动,该反应为放热反应,温度越低,平衡常数越大,所以有KA>KB,答案为:>;②从表格中可以看出氢气和二氧化碳的浓度先增大,后又减小,但最终的浓度是增大的,乙烯的浓度始终在增大,说明化学平衡横向移动,各物质的量浓度增大、平衡正向移动,说明是缩小容器的体积,答案为:D;③根据表格可以画出CH2=CH2的浓度随反应时间的变化曲线: ,答案为:
,答案为: ;(4)在催化剂M的作用下,CO2和H2同时发生下列两个反应:A.2CO2 (g)+ 6H2(g)
;(4)在催化剂M的作用下,CO2和H2同时发生下列两个反应:A.2CO2 (g)+ 6H2(g)![]() CH2= CH2(g) +4H2O(g) △H< 0和 B.2CO2(g) + 6H2(g)
CH2= CH2(g) +4H2O(g) △H< 0和 B.2CO2(g) + 6H2(g)![]() CH3OCH3(g)+3H2O(g) △H< 0,上右图是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因不可能是:反应A是放热反应,温度升高,平衡常数减小,不可能是B,反应不变,反应的活化能不变,所以B反应的活化能不可能变,不可能是D,答案为:B D;(5)已知H2CO3的第一步、第二步电离常数分别约为Ka1=4×10-7 ,Ka2=5×10-11,那么反应CO32-+H2O
CH3OCH3(g)+3H2O(g) △H< 0,上右图是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因不可能是:反应A是放热反应,温度升高,平衡常数减小,不可能是B,反应不变,反应的活化能不变,所以B反应的活化能不可能变,不可能是D,答案为:B D;(5)已知H2CO3的第一步、第二步电离常数分别约为Ka1=4×10-7 ,Ka2=5×10-11,那么反应CO32-+H2O![]() HCO3-+OH-的平衡常数K=KW/ Ka2=2×10-4,溶液中c(OH-)=
HCO3-+OH-的平衡常数K=KW/ Ka2=2×10-4,溶液中c(OH-)=![]() =1.0×10-2,溶液的pH为12,答案为:12.
=1.0×10-2,溶液的pH为12,答案为:12.


科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物。则下列说法错误的是
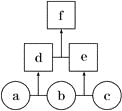
A. 常温下,单质a呈气态 B. 单质c具有强氧化性
C. 稳定性:d>e D. f受热易分解为d和e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化可以减少环境污染,而且生成的CO和H2被称作合成气,能合成很多基础有机化工原料。
(1)一定条件下,H2 、CO在体积固定的绝热密闭容器中发生如下反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g),下列选项能判断该反应达到平衡状态的依据的有________。
CH3OCH3(g)+H2O(g),下列选项能判断该反应达到平衡状态的依据的有________。
A.v(H2)=2v(CO)
B.平衡常数K不再随时间而变化
C.混合气体的密度保持不变
D.混合气体的平均相对分子质量不随时间而变化
(2)工业可采用CO与H2反应合成再生能源甲醇,反应:CO(g)+2H2(g) ![]() CH3OH(g),在一容积可变的密闭容器中充有10 mol CO和20 mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T )、压强(p)的关系如下图1所示。
CH3OH(g),在一容积可变的密闭容器中充有10 mol CO和20 mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T )、压强(p)的关系如下图1所示。
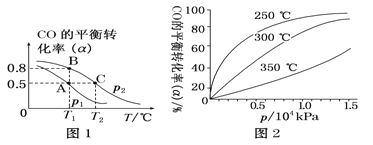
①合成甲醇的反应为________(填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为________,p1和p2的大小关系为______。
③若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为_______ L。
④ CO的平衡转化率(α)与温度(T )、压强(p)的关系如上图2所示,实际生产时条件控制在250 ℃ 、1.3×104 kPa左右,选择此压强的理由是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生在实验室用高锰酸钾制取氧气,错将其当做氯酸钾,向其中加入了二氧化锰,测得混合物总质量为400g,其中钾元素的质量分数为19.5%,放入试管中加热一段时间后,将所得固体加入足量水搅拌、过滤后,经实验测定得到只含一种溶质的滤液,则该同学加入的MnO2有多少克()
A.84gB.32gC.87gD.197g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 对于平衡体系:mA(g)+ nB(g)![]() pC(g)+ qD(g),下列判断正确的是( )
pC(g)+ qD(g),下列判断正确的是( )
A.若温度不变将容器的容积增大1倍,达到新平衡时A的浓度变为原来的0.45 倍,则m+n>p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若升高平衡体系的温度,达到新平衡时A 的浓度变为原来的0.55 倍,说明该反应△ H<0
D.若平衡后同时增大A、B的浓度,则A、B的转化率一定都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物分子中所含原子团及其数目如表.则x的值为( )
原子团 | ﹣CH2﹣ |
| ﹣CH3 | ﹣NH2 | ﹣OH |
个数 | n | m | a | 2 | X |
A.m﹣a B.n+m+a C.m+2n﹣a D.2n+3m﹣a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向5 mL 0.1 mol·L-1 的KI溶液中滴加5~6滴0.1 mol·L-1 的FeCl3溶液后,再进行下列实验,其中可证明FeCl3溶液和KI溶液的反应是可逆反应的实验是( )
A.再滴加AgNO3溶液,观察是否有AgI沉淀产生
B.加入CCl4振荡后,观察下层液体颜色
C.再滴加AgNO3溶液,观察是否有AgCl沉淀产生
D.再滴加KSCN溶液,观察是否有血红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com