
| A. | 无色透明的水溶液中:K+、Ba2+、I-、MnO4- | |
| B. | 能与Al反应产生H2的溶液中:HCO3-、Na+、Al3+、Br- | |
| C. | 澄清透明溶液中:K+、Fe3+、HCO3-、AlO2- | |
| D. | 常温下pH=1的溶液中:Mg2+、Cl-、SO42-、Fe3+ |
分析 A.MnO4-为紫色;
B.能与Al反应产生H2的溶液,为酸或强碱溶液;
C.离子之间相互促进水解;
D.pH=1的溶液,显酸性,该组离子之间不反应.
解答 解:A.MnO4-为紫色,与无色不符,故A不选;
B.能与Al反应产生H2的溶液,为酸或强碱溶液,酸碱溶液中均不能大量存在HCO3-,且HCO3-、Al3+相互促进水解不能共存,故B不选;
C.Fe3+分别与HCO3-、AlO2-相互促进水解不能共存,HCO3-、AlO2-不能共存,故C不选;
D.pH=1的溶液,显酸性,该组离子之间不反应,可大量共存,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意水解反应、复分解反应的判断,题目难度不大.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 生石灰溶于水 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与二氧化碳的反应 | D. | 铁与稀硫酸的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 稀硫酸与氢氧化钡溶液反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 将大理石投入到足量盐酸中:CO32-+2H+═CO2↑+H2O | |
| C. | 将Cl2与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 碳酸钠溶液显碱性:CO32-+H2O?HCO3-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电子由铜片通过导线流向锌片 | B. | 锌片是正极,铜片上有气泡产生 | ||
| C. | 锌片逐渐溶解 | D. | 该装置能将电能转变为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
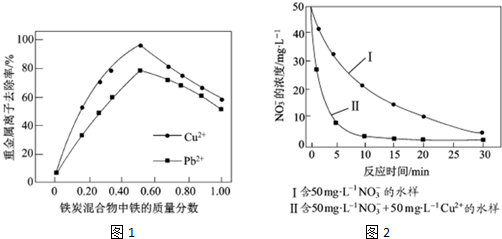
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯均能发生加成反应 | |
| B. | 石油干馏可得到汽油、煤油等 | |
| C. | 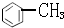 的一溴代物和 的一溴代物和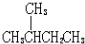 的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) | |
| D. | 乙酸乙酯、油脂、淀粉均能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
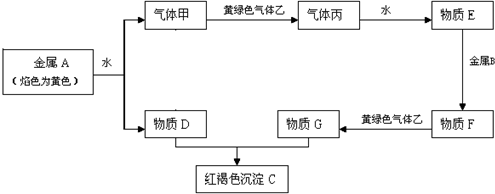
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com