

分析 A为CH3OH,在Cu作催化剂、加热条件下氧化生成B为HCHO,B与氨气分子脱去1分子水生成CH2=NH2,CH2=NH2与HCN发生加成反应生成D,D水解得到甘氨酸(H2NCH2COOH),则D为H2NCH2CN,据此解答.
解答 解:A为CH3OH,在Cu作催化剂、加热条件下氧化生成B为HCHO,B与氨气分子脱去1分子水生成CH2=NH2,CH2=NH2与HCN发生加成反应生成D,D水解得到甘氨酸(H2NCH2COOH),则D为H2NCH2CN.
(1)A→B的化学方程式:2CH3OH+O2$→_{△}^{Cu}$2HCHO+2H2O,其反应类型为氧化反应,
故答案为:2CH3OH+O2$→_{△}^{Cu}$2HCHO+2H2O;氧化反应;
(2)甲醇分子间存在氢键,则沸点甲醇>甲醛,
故答案为:>;甲醇分子间存在氢键;
(3)C→D的化学方程式:CH2=NH+HCN→H2N-CH2-CH2,
故答案为:CH2=NH+HCN→H2N-CH2-CH2;
(4)甘氨酸的同分异构体的结构简式:CH3CH2NO2 或 HO-CH2CONH2 等,2分子甘氨酸形成一种二肽的结构简式:H2NCH2CONHCH2COOH,
故答案为:CH3CH2NO2 或 HO-CH2CONH2 等;H2NCH2CONHCH2COOH.
点评 本题考查有机物的合成,根据转化故选中分子式判断发生的反应,侧重考查学生分析推理能力,难度不大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | H2SO4与Ba(OH)2溶液反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 向Na2CO3溶液中通入少量CO2:CO32-+CO2+H2O═2HCO3- | |
| D. | CH3COOH溶液与NaOH溶液反应:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2是氧化剂 | B. | I2是还原产物 | ||
| C. | 上述反应属于置换反应 | D. | 上述反应属于离子反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
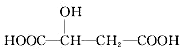 下列说法正确的是( )
下列说法正确的是( )| A. | 苹果酸分子中存在5种不同种类的氢原子 | |
| B. | 1mol苹果酸可与3mol NaOH完全中和 | |
| C. | 苹果酸与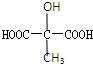 互为同分异构体 互为同分异构体 | |
| D. | 苹果酸分子中的所有碳原子可能处在同一条直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | c电极的名称为正极,d电极上的电极反应式为CH4-8e-+4O2-═CO2+2H2O | |
| B. | 如图2所示,a电极上的电极反应式为4OH--4e-═2H2O+O2↑ | |
| C. | 如图2所示电解100mL0.5mol/LCuSO4溶液,若a电极产生56mL(标准状况)气体,则所得溶液的pH=1(不考虑溶液体积变化) | |
| D. | 若要使电解质溶液恢复到电解前的状态,可加入Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以X浓度变化表示的反应速率为0.01mol•L-1•S-1 | |
| B. | 将容器体积变为2L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{1}{1}$ | B. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{4}{1}$ | C. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{1}{4}$ | D. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{3}{2}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com