
【题目】电子工业中用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液.由该废液回收铜并得到净水剂(FeCl36H2O)的步骤如下:Ⅰ.在废液中加入过量铁粉,过滤;
Ⅱ.向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
Ⅲ.合并Ⅰ和Ⅱ中的滤液,通入足量氯气;
Ⅳ.…,得到FeCl36H2O晶体.
(1)用FeCl3溶液腐蚀铜箔的离子方程式是 .
(2)试剂A是 .
(3)步骤Ⅲ中发生的离子方程式为 .
(4)完成步骤Ⅳ需要用到的实验装置是(填字母).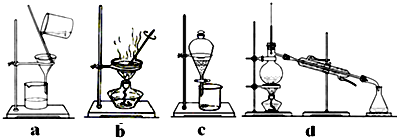
(5)若用FeCl36H2O晶体配制100ml 0.5mol/L的FeCl3溶液①用托盘天平称FeCl36H2O晶体,其质量是g.
②实验时下图所示操作的先后顺序为(填编号).
蒸馏水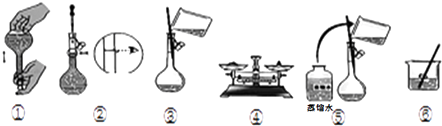
【答案】
(1)2Fe3++Cu═2Fe2++Cu2+
(2)盐酸
(3)2Fe2++Cl2=2Fe3++2Cl﹣
(4)ab
(5)13.5;④⑥③⑤②①
【解析】解:用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液,则废液中含FeCl3、FeCl2、CuCl2 . Ⅰ.在废液中加入过量铁粉,则会与FeCl3反应生成FeCl2 , 与CuCl2反应生成FeCl2和Cu,过滤,则滤液中含FeCl2;滤渣中含Cu和过量的Fe粉;Ⅱ.I的滤渣中含Cu和过量的Fe粉,向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜,故加入的试剂A只能将铁反应掉,则A为盐酸,所得的溶液中含FeCl2;
Ⅲ.I和II中的滤液中均为FeCl2 , 通入足量氯气,反应生成FeCl3;Ⅳ.…,得到FeCl36H2O晶体.(1)铜与氯化铁反应生成氯化铁、氯化亚铁,化学反应的离子方程式为:2Fe3++Cu═2Fe2++Cu2+ , 故答案为:2Fe3++Cu═2Fe2++Cu2+;(2)试剂A只能将铁反应掉,不和铜反应,且不能引入杂质离子,故A为盐酸,故答案为:盐酸;(3)III中的溶液中为FeCl2 , 通入足量氯气,将FeCl2反应生成FeCl3 , 反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl﹣ , 故答案为:2Fe2++Cl2=2Fe3++2Cl﹣;(4)由FeCl3溶液得FeCl36H2O晶体的方法是加热蒸发、浓缩结晶,然后过滤,故选ab,故答案为:ab;(5)①若用FeCl36H2O晶体配制100ml 0.5mol/L的FeCl3溶液,氯化铁物质的量=0.1L×0.5mol/L=0.05mol,则晶体物质的量为0.05mol,需要称量的固体质量=0.05mol×270.5g/mol=13.525g≈13.5g,故答案为:13.5;②配制溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤转入、定容、摇匀等操作得到,实验时下图所示操作的先后顺序为④⑥③⑤②①,
故答案为:④⑥③⑤②①;
用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液,则废液中含FeCl3、FeCl2、CuCl2 . Ⅰ.在废液中加入过量铁粉,则会与FeCl3反应生成FeCl2 , 与CuCl2反应生成FeCl2和Cu,过滤,则滤液中含FeCl2;滤渣中含Cu和过量的Fe粉;Ⅱ.I的滤渣中含Cu和过量的Fe粉,向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜,故加入的试剂A只能将铁反应掉,则A为盐酸,所得的溶液中含FeCl2;
I和II中的滤液中均为FeCl2 , 通入足量氯气,反应生成FeCl3;Ⅳ.…,得到FeCl36H2O晶体.据此分析,(1)铜与氯化铁反应生成氯化铁、氯化亚铁;(2)试剂A只能将铁反应掉,不和铜反应,且不能引入杂质离子;(3)III中的溶液中为FeCl2 , 通入足量氯气,将FeCl2反应生成FeCl3;(4)由FeCl3溶液得FeCl36H2O晶体的方法是加热蒸发、浓缩结晶,然后过滤;(5)若用FeCl36H2O晶体配制100ml 0.5mol/L的FeCl3溶液,氯化铁物质的量=0.1L×0.5mol/L=0.05mol,则晶体物质的量为0.05mol,计算得到称量的质量,托盘天平称量到0.1g,配制溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤转入、定容、摇匀等操作得到;


科目:高中化学 来源: 题型:
【题目】A,B,C,D都是含单官能团的化合物,A水解得B和C,B氧化可以得到C或D,D氧化也可得到C.若M(X)表示X的摩尔质量,则下列关系式正确的是( )
A.M(A)═M(B)+M(C)
B.2M(D)═M(B)+M(C)
C.2M(B)>M(D)+M(C)
D.M(D)<M(B)<M(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对乙酰氨基苯酚M( ![]() )是最常见的消炎解热镇痛药,用于治疗感冒发烧和关节痛等.M的一种合成路线如下:
)是最常见的消炎解热镇痛药,用于治疗感冒发烧和关节痛等.M的一种合成路线如下: 
已知:①X,Y,T分子的核碰共振氢谱只显示1组峰,且X能使溴水褪色;
② ![]() .
.
(1)X,Y的结构简式为、;
(2)Ⅲ的反应类型为 , Ⅵ的反应方程式为;
(3)M与足量氢氧化钠溶液反应的化学方程式为;
(4)M有多种同分异构体,其中一类与J互为同系物且氮原子与苯环直接相连,此类同分异构体共有种; 另一类同分异构体同时满足下列条件①属于对位二取代苯且苯环上连有﹣NH2;②能发生水解反应;③核碰共振氢谱有4组峰.写出其中一种同分异构体的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X,Y,Z,W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( ) 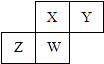
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:X>W>Z
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.元素X,Z,W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单斜硫和正交硫转化为二氧化硫的能量变化如图所示,下列说法不正确的是( ) 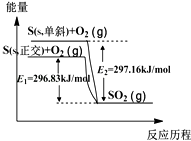
A.单斜硫和正交硫互为同素异形体
B.正交硫比单斜硫稳定
C.相同物质的量的正交硫比单斜硫所含有的能量高
D.由单斜硫制取正交硫是一个放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ/mol
②CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2(g);△H=﹣192.9kJ/mol
O2(g)=CO2(g)+2H2(g);△H=﹣192.9kJ/mol
下列说法错误的是( )
A.1mol CH3OH(g)完全燃烧放出的热量大于192.9 kJ
B.根据反应①和②推知反应:H2(g)+ ![]() O2(g)=H2O(g)的△H=﹣241.9kJ/mol
O2(g)=H2O(g)的△H=﹣241.9kJ/mol
C.CH3OH转变成H2的过程不一定要吸收能量
D.
反应①中的能量变化如图所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( ) 
A.加热时,①上部汇聚了固体碘,说明碘的热稳定性较差
B.加热时,②、③中的溶液均变红,冷却后又都变为无色
C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅
D.四个“封管实验”中都有可逆反应发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaI和NaBr的混合溶液中通入足量的氯气,充分反应后将溶液蒸干,灼烧上述残留物,最后得到的物质是
A. NaCl、I2 B. NaCl、NaBr C. NaBr、I2 D. NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu. 
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题: ①图中X溶液是;②Cu电极上发生的电极反应式为;
③原电池工作时,盐桥中的离子(填“K+”或“Cl﹣”)不断进入X溶液中.
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题: ①M是极;②图丙中的②线是离子的变化.
③当电子转移为2mol时,向乙烧杯中加入L 5molL﹣1NaOH溶液才能使所有的金属阳离子沉淀完全.
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点. ①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O ![]() Na2FeO4+3H2↑,则电解时阳极的电极反应式是 .
Na2FeO4+3H2↑,则电解时阳极的电极反应式是 .
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为 .
③Na2FeO4能消毒、净水的原因 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com