
| A. | 铝合金的密度小,硬度大,可用作建筑材料 | |
| B. | 食品工业用Na2CO3作焙制糕点的膨松剂 | |
| C. | FeCl3溶液能与Cu反应,可用于腐蚀铜制印刷电路板 | |
| D. | 明矾能生成Al(OH)3胶体,可用作净水剂 |
分析 A.合金硬度大;
B.Na2CO3的碱性较强;
C.FeCl3溶液能与Cu反应生成氯化铜、氯化亚铁;
D.明矾水解生成的胶体具有吸附性.
解答 解:A.铝合金的密度小,硬度大,具有优良的性能,则可用作建筑材料,故A正确;
B.Na2CO3的碱性较强,因选NaHCO3作焙制糕点的膨松剂,故B错误;
C.FeCl3溶液能与Cu反应生成氯化铜、氯化亚铁,则可用于腐蚀铜制印刷电路板,故C正确;
D.明矾水解生成的胶体具有吸附性,则明矾可用作净水剂,故D正确;
故选B.
点评 本题考查物质的性质与应用,为高频考点,把握物质的性质、发生的反应、性质与用途为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
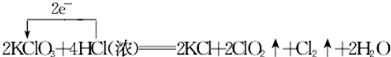 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
| A. | 增加Fe2O3固体可以提高CO的转化率 | |
| B. | 减小容器体积既能提高反应速率又能提高平衡转化率 | |
| C. | 该反应的正反应△H<0 | |
| D. | 当容器内气体密度恒定时,不标志该反应已达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 装置 | 步骤 | 现象 |
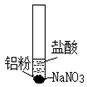 | ⅰ.取少量铝粉于试管,并加入盐酸 | 初始未见明显现象,一段时间后,冒出无色气泡. |
| ⅱ.在试管加入硝酸钠固体 | 继续冒出气泡,液面上方呈浅棕色,试管逐渐变热至沸腾. | |
| ⅲ.用湿润KI-淀粉试纸靠近试管口 | KI-淀粉试纸变蓝色. |
| 装置 | 步骤 | 现象 |
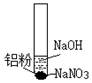 | ⅰ.取少量铝粉于试管,并加入氢氧化钠溶液 | 初始未见明显现象,一段时间后,冒无色气泡. |
| ⅱ.向试管中加入硝酸钠固体 | 继续冒出无色气泡,并有刺激性气味产生 | |
| ⅲ.用湿润红色石蕊试纸靠近试管口 | 试纸变蓝 | |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.信息二:氯化铬酰(CrO2Cl2)是铬的一种化合物,常温下该化合物是暗红色液体,熔点为-96.5℃,沸点为117℃,能和丙酮(CH3COCH3)、四氯化碳、CS2等有机溶剂互溶.
信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.信息二:氯化铬酰(CrO2Cl2)是铬的一种化合物,常温下该化合物是暗红色液体,熔点为-96.5℃,沸点为117℃,能和丙酮(CH3COCH3)、四氯化碳、CS2等有机溶剂互溶.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,有关桶烯的说法不正确的是( )
,有关桶烯的说法不正确的是( )| A. | 不慎将桶烯洒到地面瓷砖上,可用火烤干 | |
| B. | 桶烯在一定条件下能与3molBr2发生加成反应 | |
| C. | 桶烯与苯乙烯互为同分异构体 | |
| D. | 桶烯分子中所有的碳原子一定不在同一个平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 转移电子的物质的量为1.25 mol | |
| B. | 生成42.0 L N2(标准状况) | |
| C. | 有0.250 mol KNO3被氧化 | |
| D. | 被还原的N原子的物质的量为3.75 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com