
| A. | 2:1 | B. | 5:1 | C. | 7:2 | D. | 8:1 |
分析 将H2和O2混合气体通入密闭容器中(温度为120℃),测得总压强为3.0×105Pa,点燃,氢气与氧气反应生成水,冷却到原温度.若反应后总压强降为2.5×105Pa,根据压强之比等于物质的量之比计算.
解答 解:将H2和O2混合气体通入密闭容器中(温度为120℃),测得总压强为3.0×105Pa,点燃,氢气与氧气反应生成水,冷却到原温度,若反应后总压强降为2.5×105Pa,设H2为xmol,O2为ymol,
若氢气过量,按照氧气计算;
O2+2H2$\frac{\underline{\;点燃\;}}{\;}$2H2O
y 2y 2y
则$\frac{x+y}{x+y-3y+2y}$=$\frac{3.0×1{0}^{5}}{2.5×1{0}^{5}}$,解得x:y=5:1;
若氧气过量,按照氢气计算;
O2+2H2$\frac{\underline{\;点燃\;}}{\;}$2H2O
0.5x x x
则$\frac{x+y}{x+y-1.5x+x}$=$\frac{3.0×1{0}^{5}}{2.5×1{0}^{5}}$,解得x:y=1:2;
故选B.
点评 本题考查了有关方程式的计算,题目难度中等,注意根据方程式结合过量计算,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 14 g乙烯气体中的氢原子数约为2×6.02×1023 | |
| B. | 标准状况下,2.24 L H2O含有的共价键数约为0.2×6.02×1023 | |
| C. | 1 mol N2与3 mol H2反应生成的NH3分子数约为2×6.02×1023 | |
| D. | 0.1 L 0.5 mol/L CH3COOH溶液中含有的氢离子数约为0.05×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+为重金属离子,故CuSO4不能用于生活用水消毒 | |
| B. | 卤水煮豆腐是Mg2+、Ca2+等使蛋白质胶体发生凝聚过程 | |
| C. | 纯碱溶液可以洗涤餐具上的油渍 | |
| D. | 油漆刷在钢铁护栏表层用来防止金属锈蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 方案 | 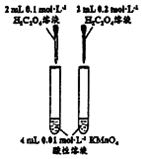 |  | 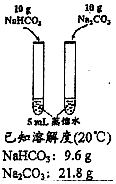 |  |
| 目的 | 探究浓度对化学反应速率的影响 | 制备氨气 | 室温下比较NaHCO3和Na2CO3的溶解度 | 探究温度对化学平衡的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
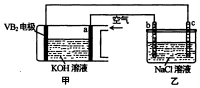 碱性硼化钒--空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5,室温下用该电池为电源,用惰性电极电解饱和氯化钠溶液,装置如图.当外电路中通过0.04mol电子时,乙装置中溶液的体积为400mL.则下列说法正确的是( )
碱性硼化钒--空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5,室温下用该电池为电源,用惰性电极电解饱和氯化钠溶液,装置如图.当外电路中通过0.04mol电子时,乙装置中溶液的体积为400mL.则下列说法正确的是( )| A. | 外电路中电子由a电极流向b电极 | |
| B. | 电极上生成气体的体积为4.48L | |
| C. | 乙装置中溶液的pH为13 | |
| D. | VB2电极发生的电极反应为:VB2+11H2O-22e-=VB2+2B2O3+22H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com