

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 4.7 | 5.4 |
| 完全沉淀 | 3.2 | 9.7 | 6.7 | 8.0 |
分析 (1)电解精炼铜时,精铜做阴极,粗铜作阳极,阴极上是铜离子得电子;根据锌、铁与硫酸铜发生置换反应分析;
(2)滴加H2O2能将亚铁离子氧化为三价铁离子便于除去,且不引入杂质,据此书写方程式;
(3)慢慢加入氢氧化钠,搅拌,以控制溶液pH,目的是让三价铁离子完全沉淀,铜离子不沉淀;
(4)根据精炼铜原理,滤渣1为比铜还不活泼的Ag、Au,金属银可以和硝酸反应得到硝酸银以及水和一氧化氮,金不反应,据此书写方程式.
解答 解:(1)在电解精炼铜时,阳极反应是金属锌、铁、镍等先失电子,阴极上是铜离子得电子产生铜,电解反应为:Cu2++2e-═Cu,精铜做阴极,粗铜作阳极;硫酸铜的浓度会变小,原因是锌、铁与硫酸铜发生置换反应,故答案为:阳;Cu2++2e-═Cu;变小;
(2)滴加H2O2能将亚铁离子氧化为三价铁离子便于除去,过氧化氢为氧化剂,二价铁为还原剂,所以反应为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)除去铁离子得到纯净的硫酸铜溶液,根据沉淀PH范围可知,应调节PH,使三价铁完全沉淀,铜离子不沉淀,所以加NaOH溶液调节溶液pH的范围是3.2≤pH<4.7,故答案为:3.2≤pH<4.7;
(4)金属银可以和稀硝酸反应生成硝酸银、一氧化氮和水,金不反应,所以滤渣1与硝酸反应的化学方程式为:3Ag+4HNO3═3AgNO3+NO↑+2H2O;故答案为:3Ag+4HNO3═3AgNO3+NO↑+2H2O.
点评 本题考查了电解精炼铜原理以及电解液的分离与提纯,综合性较强,考查角度广,难度较大.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:解答题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 (10-10m) | 0.73 | 1.02 | 1.34 | 1.06 | 0.99 | 1.54 | 0.75 | 1.18 |
| 最高或最 低化合价 | +6 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -2 | -3 | -1 | -3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴化亚铁溶液中通入过量氯气.2Fe2++2Br-+2C12═2Fe3++Br2+4C1- | |
| B. | 草酸和少量烧碱溶液:H2C2O4+OH-═HC2O4-+H2O | |
| C. | 漂白粉溶液吸收过量的二氧化碳:ClO-十H2O+CO2═HClO+HCO3- | |
| D. | 向NH4HSO4稀溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全NH4++H++SO42-+Ba2++2OH-═NH3•H2O+BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,
, .写出H→I的反应方程式
.写出H→I的反应方程式 .
. 或
或 .
.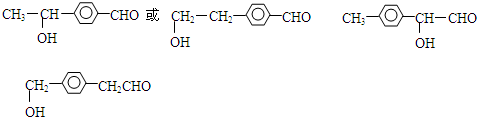 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子数之比为3:2 | B. | 同温同压下密度比是2:3 | ||
| C. | 同温同压下质量比是3:2 | D. | 标准状况下体积比是2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm. |
| Y | 所在主族序数与所在周期序数之差为4. |
| Z | 原子半径为0.102nm,核外最外层电子数是其电子层数的2倍,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰. |
| D | 最高价氧化物对应的水化物,能电离出离子数、电子数都相等的阴、阳离子. |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 强电解质 | C | NaCl | CaCO3 | HNO3 |
| 弱电解质 | CH3COOH | NH3 | HCl | H2O |
| 非电解质 | 蔗糖 | BaSO4 | C2H5OH | 酒精 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁晶须是合金 | B. | 铁晶须不与酸反应 | ||
| C. | 铁晶须可被磁铁吸引 | D. | 铁晶须易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 操 作 | 现 象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C 中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
| 甲 | 大量白色沉淀 |
| 乙 | 少量白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com