
| A. | 在标准状况下,VL气态烯烃(CnH2n)含碳碳双键的数目为$\frac{V}{22.4}$ NA | |
| B. | 在8.4 g NaHCO3晶体中,所含离子数目为0.3NA | |
| C. | 5.6g铁粉与稀硝酸反应,转移的电子数是0.3 NA | |
| D. | 在沸水中滴加含0.1 molFe3+的FeCl3饱和溶液,得到的Fe(OH)3胶粒数为0.1NA |
分析 A、求出烯烃CnH2n的物质的量,然后根据烯烃CnH2n中含有一个碳碳双键来分析;
B、求出碳酸氢钠晶体的物质的量,然后根据碳酸氢钠晶体由钠离子和碳酸氢根构成来分析;
C、铁粉与稀硝酸反应后可能变为+3价,还可能变为+2价;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体.
解答 解:A、标况下VL气态烯烃CnH2n的物质的量为n=$\frac{V}{22.4}$mol,而烯烃CnH2n中含有一个碳碳双键,故$\frac{V}{22.4}$mol此烯烃中含有的碳碳双键的个数为$\frac{V}{22.4}{N}_{A}$个,故A正确;
B、8.4g碳酸氢钠晶体的物质的量为0.1mol,而碳酸氢钠晶体由钠离子和碳酸氢根构成,故0.1mol碳酸氢钠晶体中含有的离子总数为0.2NA个,故B错误;
C、铁粉与稀硝酸反应后可能变为+3价,还可能变为+2价,故5.6g铁粉即0.1mol铁粉反应后转移的电子数可能为0.3NA个,还可能为0.2NA个,故C错误;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故得到的氢氧化铁胶粒的个数小于0.1NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意公式的运用和物质的结构特点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 轮船的船体外侧镶嵌一定量的锌块,可以减缓轮船被腐蚀的速度,称之为牺牲阳极的阴极保护法 | |
| B. | 工业生产中,常将氯气通入澄清石灰水中,制取漂白粉 | |
| C. | 氢氧燃料电池、铅蓄电池、硅太阳能电池都利用了原电池原理 | |
| D. | 夏天雷雨过后空气特别清新是因为空气中产生了少量二氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂的种类很多,但它们水解后都一定有一产物相同 | |
| B. | 光照下,异丁烷与Cl2发生取代反应生成的一氯代物有三种 | |
| C. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| D. | 聚乙烯、蛋白质和纤维素都是天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 结论 | |
| A. | 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 | 生成的1,2-二溴乙烷无色、可溶于四氯化碳 |
| B. | 乙醇和水都可与金属钠反应产生可燃性气体 | 乙醇分子中的氢与水分子中的氢具有相同的活性 |
| C. | 用乙酸浸泡水壶中的水垢,可将其清除 | 乙酸的酸性小于碳酸的酸性 |
| D. | 甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红 | 生成的氯甲烷具有酸性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a<7 | |
| B. | 该溶液中水电离的c(OH-)=10-amol/L | |
| C. | CH3COO-水解的百分率为$\frac{10-a}{0.1}$×100% | |
| D. | c(CH3COOH)=(l0a-14-10-a)mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,足量Fe与22.4 L Cl2反应,转移的电子数为2NA | |
| B. | 0.1molO2完全反应时,转移的电子数一定为 0.4 NA | |
| C. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为 0.2NA | |
| D. | 常温常压下,100 g 17% H2O2水溶液中含氧原子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 (b)、
(b)、 (d)、
(d)、 (p)的分子式均为C6H6,下列说法正确的是( )
(p)的分子式均为C6H6,下列说法正确的是( )| A. | b的同分异构体只有d和p两种 | |
| B. | b、d、p的二氯代物均只有三种 | |
| C. | b、d、p均可与酸性高锰酸钾溶液反应 | |
| D. | b、d、p中只有b的所有原子处于同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
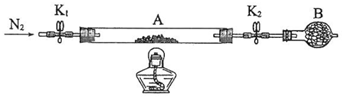
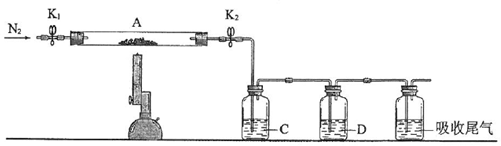
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡正向移动 | B. | B的浓度增大 | C. | A的浓度减小 | D. | 逆反应速率加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com